
某废水样品中含有一定量的K+、HCO 、SO
、SO ,甲、乙两研究小组欲测定其中SO
,甲、乙两研究小组欲测定其中SO 的 浓度。
的 浓度。
甲组方案:
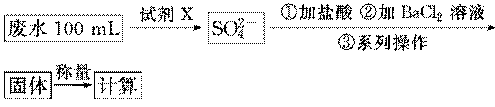
乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20. 00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO +5SO
+5SO +6H+===2Mn2++5SO
+6H+===2Mn2++5SO +3H2O)。
+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO 的离子方程式为________________。
的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
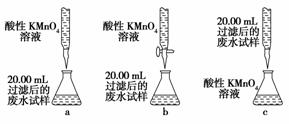
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终 点时可观察到的现象是__________________。
 ]
]
解析 (1)加入试剂X后所得溶液中含有SO ,故试剂X为氧化剂,排除选项b、d;由于最后需要测定SO
,故试剂X为氧化剂,排除选项b、d;由于最后需要测定SO ,故不能用含有SO
,故不能用含有SO 的高锰酸钾溶液,排除a;新制氯水 具 有氧化性,且对后续定量实验没有影响,合理选项为c。(2)新制氯水中含
的高锰酸钾溶液,排除a;新制氯水 具 有氧化性,且对后续定量实验没有影响,合理选项为c。(2)新制氯水中含 有Cl2,能够将 SO
有Cl2,能够将 SO 氧化为SO
氧化为SO ,而本身被还原为Cl-。(3)经第①步、第②步操作后产生沉淀,故第③步操作为过滤,然后对滤渣进行洗涤,干燥。(4)高锰酸钾具有强氧化性,容易腐蚀 碱式滴定管的橡胶管,故高锰酸钾应该用酸式滴定管盛装,a错;乙组方案第②步中提 示“精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO
,而本身被还原为Cl-。(3)经第①步、第②步操作后产生沉淀,故第③步操作为过滤,然后对滤渣进行洗涤,干燥。(4)高锰酸钾具有强氧化性,容易腐蚀 碱式滴定管的橡胶管,故高锰酸钾应该用酸式滴定管盛装,a错;乙组方案第②步中提 示“精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO 4酸化)溶液进行滴定”,故锥形瓶中应盛装废水试样,而滴定管中应该盛高锰酸钾溶液,c错。
4酸化)溶液进行滴定”,故锥形瓶中应盛装废水试样,而滴定管中应该盛高锰酸钾溶液,c错。
答案 (1)c
(2)SO +Cl2+H2O===SO
+Cl2+H2O===SO +2Cl-+2H+
+2Cl-+2H+
(3)过滤、洗涤、干燥
(4)b 溶液由无色变为紫红色


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式___________________________________________________________。
(2)根据等电子原理,写出CO分子的结构式_________________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________________________________;
甲醛分子中碳原子轨道的杂化类型为___________________。
②甲醛分子的空间构型是__________________;1 mol甲醛分子中σ键的数目为____________。
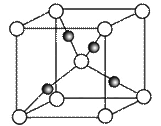
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu+数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A.乙烯与氯气加成反应的产物是Cl—CH2—CH2—Cl
B.苯分子中含有三个C-C键和三个C=C键
C.甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢
D.某有机物完全燃烧后生成CO2和H2O,则该物质必定含有碳、氢、氧三
种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为________。
(3)CH4中共用电子对偏向C,SiH 4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______________________________________________。
4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中除去杂质应选用的试剂或操作方法正确的是( )
| 选项 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | KNO3溶液 | KOH | 加入FeCl3溶液,并过 |
| B | FeC | FeCl2 | 加入稍过量 |
| C | CO | O2 | 通过灼热的铜网后收集气体 |
| D | K2CO3固体 | NaHCO3 | 置于坩埚中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由1-溴丁烷制取少量的1,2-丁二醇 时,需要经过下列哪几步反应
A.取代、消去、加成 B.加成、消去、取代
C.消去、加成、取代 D.消去、加成、消去
查看答案和解析>>
科目:高中化学 来源: 题型:
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
A.该生产过程不会产生污染 B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应 D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com