
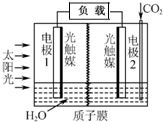
 利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
利用人工模拟光合作用合成甲酸的原理为:2CO2+2H2O$→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )| A. | 电子由电极1经过负载流向电极2 | |
| B. | 若将质子膜换成阴离子交换膜,该电池依然能够正常工作 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
分析 离子交换膜为质子膜,则电解质溶液呈酸性,根据方程式知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,负极上水失电子生成氢离子和氧气;电子由负极沿导线流向正极;2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH;通过光照,该装置是太阳能转化为化学能和电能,据此分析.
解答 解:离子交换膜为质子膜,则电解质溶液呈酸性,根据方程式知,该反应中C元素化合价由+4价变为+2价,O元素化合价由-2价变为0价,所以1是负极、2是正极,负极上水失电子生成氢离子和氧气;电子由负极沿导线流向正极;2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH;通过光照,该装置是太阳能转化为化学能和电能,
A.电子由负极沿导线流向正极,1是负极、2是正极,所以电子由电极1经过负载流向电极2,故A正确;
B.若将质子膜换成阴离子交换膜,质子无法通过交换膜移动,不能平衡电荷,正极上无法按照原来的路径反应,不能制备HCOOH,故B错误;
C.2是正极,正极上二氧化碳得电子和氢离子反应生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH,故C正确;
D.通过光照,该装置是太阳能转化为化学能和电能,故D正确;
故选B.
点评 本题考查化学电源新型电池,明确正负极的判断、电极反应式类型及书写、电子流向是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1molNaCN中含共价键数为0.3NA | |
| B. | 0.1mol/LNaHCO3溶液中HCO3-的数目小于0.1NA | |
| C. | 19gH218O2含有的中子数为12NA | |
| D. | 上述反应中,当有22.4LNH3生成时,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
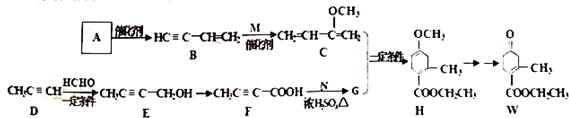
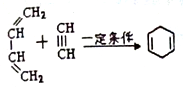 ,请回答下列问题:
,请回答下列问题: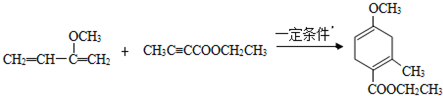 .
.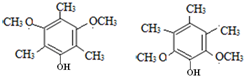 .
. )的合成路线(在相应位置填写有关反应条件及物质的结构简式):
)的合成路线(在相应位置填写有关反应条件及物质的结构简式): $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
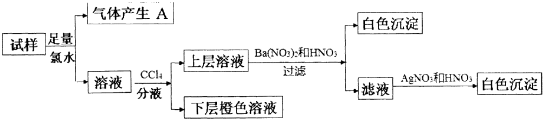
| A. | 气体A为CO2 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 原无色溶液中至少存在四种离子 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、Al3+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 | |
| B. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而加快油脂皂化反应速率 | |
| C. | 工业合成氨的反应属于能自发进行的反应,故能迅速发生 | |
| D. | 鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
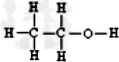 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$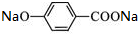 +
+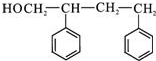 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 将饱和食盐水滴入工业电石得到的气体通入酸性KMnO4溶液中 | KMnO4溶液紫红色褪去 | 证明生成了乙炔气体 |
| B | 将BaSO4与浓Na2CO3溶液混合后振荡静置,过滤并洗净所得的沉淀,往滴加足量盐酸 | 产生使澄清石灰水变浑浊的气体 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 充分加热花生油与NaOH混合溶液(已加沸石) | 溶液不再分层 | 花生油的水解反应已经趋于完全 |
| D | 向含KSCN的FeI2溶液中滴加足量氯水 | 溶液变为血红色 | 还原性:Fe2+>I- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com