
现拟分离含乙酸、乙醇的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
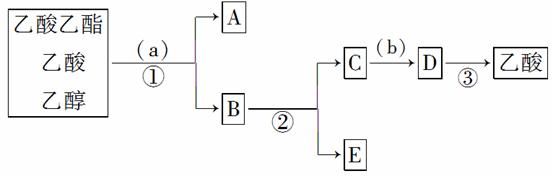
(1)写出方框内所含物质的名称(水除外):
A________________________________________________________________________,
B________________________________________________________________________,
C________________________________________________________________________,
E________________________________________________________________________。
(2)写出加入的试剂:
(a)________________________________________________________________________,
(b)________________________________________________________________________。
(3)写出有关的操作分离方法:
①________,②________,③________。
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.滴入酚酞显红色的溶液:Na+、Mg2+、NO 、HSO
、HSO
B.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO 、Cl-
、Cl-
C.0.1 mol·L-1氨水溶液:K+、Na+、NO 、AlO
、AlO
D.由水电离出的c(H+)=10-11 mol·L-1的溶液:Ca2+、NH 、Cl-、HCO
、Cl-、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:

回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为________________、________________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________,滤渣是________;过滤操作②的滤液是________和________,滤渣是________。
(3)工艺过程中③和④的目的是_________________________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是__________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为______________________;列式计算该成品的纯度____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
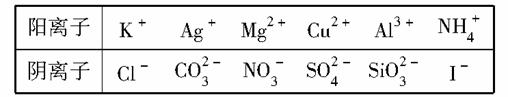
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有______;并据此推测原溶液应该呈________性,原因是________________________
(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为________________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
人剧烈运动,骨骼肌组织会供氧不足,导致葡萄糖无氧氧化,产生大量酸性物质(分子式为C3H6O3),如果该物质过度堆积于腿部,会引起肌肉酸痛。体现该物质酸性的基团是( )
A.羟基 B.甲基
C.乙基 D.羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol CnHmO2的有机物在O2中完全燃烧后,生成的CO2和H2O(g)的体积相等,并消耗44.8 L O2(标准状况)。该有机物分子中C原子数n为( )
A.1 B.2
C.3 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,只用一种试剂就能区别的是(允许加热)( )
①FeCl2、Al(NO3)3、MgSO4、NH4NO3四种溶液
②苯酚、苯乙烯、溴苯、苯四种溶液
③MnO2、CuO、C三种黑色固体
④NaCl、AlCl3、Ba(OH)2、HCl四种溶液
A.只有①③ B.只有①③④
C.只有①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
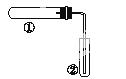
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( )
| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加 的混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com