
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是
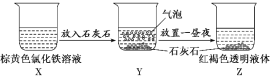
A. X、Z烧杯中分散质相同
B. Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2
C. 利用过滤的方法,可将Z中固体与液体分离
D. Z中分散系能产生丁达尔效应
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O部分信息如下:
物理性质 | 化学性质 |
红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂) | 具有强还原性,易被氧化 |
制备原理:2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O(s)。
某兴趣小组设计实验制备[Cr(CH3COO)2]22H2O(s)。

回答下列问题:
(1)仪器A的名称是_____。
(2)检查装置B气密性的操作方法是_____。
(3)加入盐酸后,关闭K1,打开K2,将装置B中的导管抽出液面以上一段时间,目的是____。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生。写出装置B中发生的非置换反应的离子方程式:_____。
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,宜采取的操作是_____;装置D中导管口水封的目的是_____。
(5)将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,用乙醚洗涤的优点有______。
(6)测定产品纯度:取ag产品溶于蒸馏水,通入足量空气,充分反应后,加入过量氢氧化钠溶液,过滤、洗涤、灼烧、称重。得Cr2O3质量为mg(假设杂质不参与反应),[Cr(CH3COO)2]22H2O(s)的摩尔质量为Mg·mol-1。测得产品纯度为____ %。(用含a、m、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中正确的是
A. 提取溶解在水中的少量碘:加入酒精振荡、静置分层后,取出有机层再分离
B. 下图所示装置都适宜于HCl气体尾气吸收
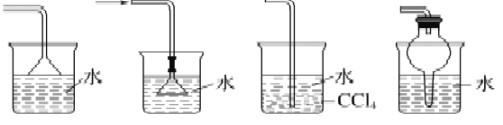
C. 酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差;在用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体。
D. 除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2 并过滤;除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。
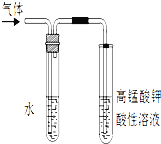
(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验:
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,
试回答下列问题:
(1)写出滴定实验中所发生反应的离子方程式:_________________________________________________________
(2)实验中KMnO4溶液应装在___________式滴定管中,滴定终点的判断依据是_______________________________
(3)滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为_______mol·L-1
(4)若滴定终点读数时目光俯视,则计算出的x值可能_______________(填“偏大”、“偏小”、“无影响”)
(5)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,则下列说法不正确的是
A. 标准状况下,18gH2O所含电子数为10NA
B. 22.4L CO2与17 g NH3所含分子数相等
C. 0.9g铝与足量的盐酸反应,失去的电子数为0.1NA
D. 常温下,1L 0.1mol/L NaCl溶液中含Na+ 数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.用如图所示的装置进行电解,在通电一段时间后,铁电极的质量增加。
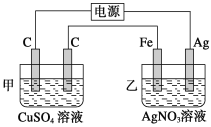
(1)写出甲中发生反应的化学方程式:____________________________。
(2)写出乙中两极发生的电极反应式。
阳极:_______________;阴极:_____________________。
Ⅱ.在一定温度下,将2mol A和2mol B两种气体相混合于容积为2 L的某密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.6mol D,并测得C的浓度为0.3mol/L,请填写下列空白:
(1)x值等于__________。
(2)A的转化率为__________。
(3)生成D的反应速率为________________。
(4)达平衡后保持容器内气体压强不变,向其中加入He(He不参加反应),则平衡______移动(填“正向”“逆向 “或”“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是________(填写化学式)。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中,反应的离子方程式为______________________。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5 mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20 mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4。(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
烧杯 | 溶液的pH | 现象 |
a | 10 | 10 min后,红纸基本不褪色;4 h后红纸褪色 |
b | 7 | 10 min后,红纸颜色变浅;4 h后红纸褪色 |
c | 4 | 10 min后,红纸颜色变得更浅;4 h后红纸褪色 |
已知,溶液中Cl2、HClO和ClO-物质的量分数(α)随溶液pH变化的关系如下图所示:
![]()

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色________。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是________。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。
①一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为________。
②另一种制备ClO2的方法是用NaClO3与盐酸反应,同时有Cl2生成,产物中Cl2体积约占1/3,每生成0.5 mol ClO2,转移________mol e-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。

Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com