
分析 反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,结合电子转移相等解答.
解答 解:(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,Cl2为氧化产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: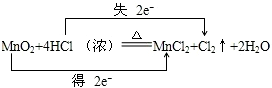 ,
,
故答案为:MnO2;Cl2;  ;
;
(2)n(HCl)=$\frac{73g}{36.5g/mol}$=2mol,
MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化HCl
1mol 4mol 22.4L 2mol
V 2mol
n=1,
故答案为:2mol;
(3)MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 转移电子数
1mol 4mol 22.4L 2mol
V 0.2mol
V=2.24L
故答案为:2.24L.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高考高频考点和常见题型,注意从元素化合价的角度分析,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
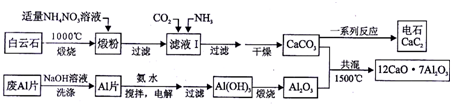
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL容量瓶,7.68g硫酸铜 | B. | 480mL容量瓶,12.0g胆矾 | ||
| C. | 500mL容量瓶,12.5g硫酸铜 | D. | 500mL容量瓶,12.5g胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 000 mL容量瓶,58.5 g NaCl | B. | 980 mL容量瓶,57.3 g NaCl | ||
| C. | 500 mL容量瓶,58.5 gNaCl | D. | 1 000 mL容量瓶,117.0 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL | B. | 600mL | C. | 800mL | D. | 1000mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素都可以在酸性条件下水解生成葡萄糖 | |
| B. | 煤的气化、液化和干馏都是煤综合利用的主要方法,都属于物理变化 | |
| C. | 地沟油发生皂化反应后加入饱和食盐水,搅拌发现液面上有固体物质 | |
| D. | 蛋白质溶液中加入浓的硫酸铵溶液,有固体析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
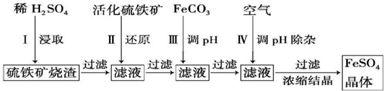
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com