
分析 (1)根据m=nM计算出0.25mol二氧化碳的质量;根据N=nNA计算含有的分子数;根据V=nVm计算标准状况下二氧化碳的体积;计算出0.25mol二氧化碳中含有的氧原子的物质的量,然后得出需要硫酸的物质的量,最后根据m=nM计算出硫酸的质量;
(2)根据c=$\frac{n}{V}$计算出该硫酸的物质的量浓度,再得出氢离子浓度;
(3)根据稀释过程中溶质的物质的量不变计算出稀释后溶液中氢离子浓度.
解答 解:(1)0.25mol二氧化碳的质量为:44g/mol×0.25mol=11g;
0.25mol二氧化碳中含有0.25NA或1.504x1023个二氧化碳分子;
标准状况下0.25mol二氧化碳的体积为:22.4L/mol×0.25mol=5.6L;
0.25mol二氧化碳分子中含有氧原子的物质的量为:0.25mol×2=0.5mol,提供0.5molO需要硫酸的物质的量为:$\frac{0.5mol}{4}$=0.125mol,则需要硫酸的质量为:98g/mol×0.125mol=12.25g,
故答案为:11;0.25NA或1.504x1023;5.6;12.25;
(2)硫酸的物质的量为0.125mol,则所得溶液中硫酸的浓度为:$\frac{0.125mol}{0.5L}$=0.25mol/L,氢离子浓度为:0.25mol/L×2=0.5mol/L,
故答案为:0.5mol/L;
(3)取出的100mL 该硫酸溶液中氢离子浓度为0.5mol/L,稀释过程中氢离子的物质的量不变,则稀释后溶液中氢离子浓度为:$\frac{0.5mol/L×0.1L}{0.5L}$=0.1mol/L,
故答案为:0.1 mol/L.
点评 本题考查了物质的量、物质的量浓度的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等之间的关系为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 计算机芯片所用的材料是高纯度的硅 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba(HCO3)2与NaOH溶液反应 | B. | NaHCO3与Ba(OH)2溶液反应 | ||
| C. | Ba(HCO3)2与Ba(OH)2溶液反应 | D. | NH4HCO3与Ba(OH)2溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
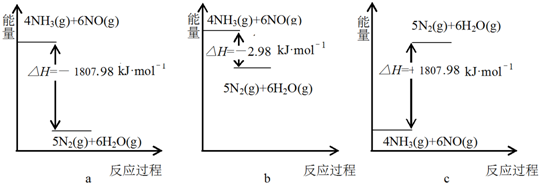
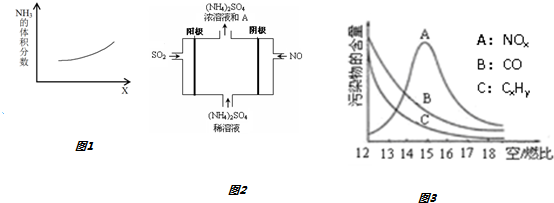
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杂化轨道全部参加形成化学键 | |
| B. | 在晶体中,只要有阴离子一定有阳离子 | |
| C. | 某固态单质能导电,该单质一定属于金属晶体 | |
| D. | SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com