
下列各组离子,在指定的环境中可能大量共存的是( )
|
| A. | 水电离出来的c(H+)=10﹣13mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+ |
|
| B. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl﹣、NO3﹣ |
|
| C. | 与金属铝反应只能放出氢气的溶液:NO3﹣、K+、Cl﹣、Na+、OH﹣ |
|
| D. | c(H+)>c(OH﹣)的溶液中:Na+、K+、SO42﹣、S2﹣ |
考点:
离子共存问题.
专题:
离子反应专题.
分析:
A.水电离出来的c(H+)=10﹣13mol/L的溶液为酸性或者碱性溶液,碳酸氢根离子能够与氢离子和氢氧根离子反应;
B.石蕊试液显红色的溶液为酸性溶液,硝酸根质量在酸性条件下能够氧化亚铁离子;
C.与金属铝反应只能放出氢气的溶液可能为酸性或者碱性溶液,碱性溶液时,NO3﹣、K+、Cl﹣、Na+、OH﹣离子之间不反应,也不与氢氧根离子反应;
D.c(H+)>c(OH﹣)的溶液为酸性溶液,硫离子能够与氢离子反应硫化氢气体.
解答:
解:A.该溶液为酸性或者碱性溶液,HCO3﹣既能够与氢离子反应,也能够与氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.该溶液为酸性溶液,NO3﹣在酸性条件下能够氧化Fe2+,在溶液中一定不能大量共存,故B错误;
C.该溶液为酸性 或者碱性溶液,NO3﹣、K+、Cl﹣、Na+、OH﹣之间不反应,且都不与氢氧根离子反应,所以在碱性溶液中四种离子可以共存,故C正确;
D.c(H+)>c(OH﹣)的溶液显示酸性,S2﹣能够与氢离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评:
本题考查离子共存的正误判断,难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能生成难溶物的离子之间;能发生氧化还原反应的离子之间;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH﹣;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4﹣等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:
在①KOH、②Al(OH)3、③H2SO4三种物质中,与盐酸和氢氧化钠溶液均能反应的是( )
|
| A. | ①②③ | B. | ②和③ | C. | ①和③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,微粒的物质的量浓度关系正确的是( )
|
| A. | 10 mL 0.5 mol•L﹣1CH3COONa溶液与6 mL 1 mol•L﹣1盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+) |
|
| B. | 0.1 mol•L﹣1pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣) |
|
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA﹣)+c(OH﹣)+c(A2﹣) |
|
| D. | 0.1 mol•L﹣1CH3COONa溶液中:c(OH﹣)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
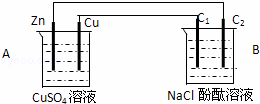
按图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为 ,B池为
(2)锌极为 极,电极反应式为
(3)石墨棒C1为 极,电极反应式为
石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中正确的是( )
|
| A. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
|
| B. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
|
| C. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
|
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,将一定质量的冰醋酸加水稀释,溶液的导电能力变化如图所示,下列说法中,正确的是( )
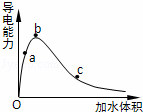
|
| A. | a、b、c三点溶液的pH:c<a<b |
|
| B. | a、b、c三点醋酸的电离程度:a<b<c |
|
| C. | 若用湿润的pH试纸测量a处溶液的pH,测量结果偏小 |
|
| D. | a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和另一种常见气体.进一步研究NH3生成量与温度的关系(其它条件均相同),部分实验数据见下表:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
回答下列问题:
(1)写出该反应的化学方程式
(2)该反应的焓变△H 0(填“>”、“<”或“=”)
(3)请在答题纸的坐标图中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注.
(4)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢.请提出可提高其反应速率且增大NH3生成量的建议: .
(5)已知:
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol
H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol
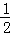 N2(g)+2H2(g)+
N2(g)+2H2(g)+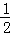 Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
Cl2(g)═NH4Cl(s)△H=﹣313.6kJ/mol
计算NH3(g)+HCl(g)═NH4Cl(s)的反应焓变:△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的溶液中,一定能大量共存的离子组是()
A. 能使pH试纸呈红色的溶液:Na+、NH4+、I﹣、NO3﹣
B. 加入铝粉生成H2的溶液:K+、Mg2+、SO42﹣、HCO3﹣
C. c(Fe3+)=0.1mol•L﹣1的溶液:H+、Al3+、I﹣、SCN﹣
D. 常温下pH=12的溶液:Na+、K+、SiO32﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com