
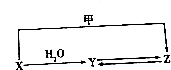
 有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.
有机物X、Y、Z的转化关系如图所示(化学反应条件已省略),又己知X的储量是衡量一个国家石油化工发展水平的标志,甲是空气的主要成分之一,Y是一种常用的液体燃料.分析 X的储量是衡量一个国家石油化工发展水平的标志,则A为CH2=CH2;X与水发生加成反应生成Y,Y是一种常用的液体燃料,则Y为CH3CH2OH,甲是空气的主要成分之一,甲为氧气,乙烯与氧气反应,乙烯发生催化氧化生成乙醛,Y为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,Z为乙醛,CH3CHO可催化加氢生成乙醇,所以Y→Z,Z→Y,据此分析解答.
解答 解:X的储量是衡量一个国家石油化工发展水平的标志,则A为CH2=CH2;甲是空气的主要成分之一,可能为氮气、氧气,能与乙烯反应,甲为氧气.
X→Y:乙烯和水在催化剂条件下可发生加成反应,反应的方程式为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
X→Z:乙烯发生催化氧化可以生成乙醛,反应方程式为:2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO,
Y→Z:Y为CH3CH2OH,乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
Z→Y:Z为乙醛,CH3CHO和H2发生还原反应生成乙醇,化学方程式为:CH3CHO+H2$\stackrel{催化剂}{→}$CH3CH2OH.
(1)Y为CH3CH2OH,含有-OH官能团,为羟基,
故答案为:羟基;
(2)有机反应中,去氧或加氢的反应为还原反应,Z→Y:Z为乙醛,CH3CHO和H2发生还原反应生成乙醇,化学方程式为:CH3CHO+H2$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:还原;
(3)X→Z:乙烯发生催化氧化可以生成乙醛,反应方程式为:2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO,
故答案为:2CH2=CH2+O2$\stackrel{催化剂}{→}$2CH3CHO.
点评 本题考查有机物推断,涉及烯与醇、醛之间的转化关系等,题目难度不大,关键是X的储量是衡量一个国家石油化工发展水平的标志,则A为CH2=CH2,注意基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  分散系的分类 | |
| B. |  稀释浓盐酸的过程 | |
| C. |  向碳酸钠溶液中逐滴滴入盐酸 | |
| D. |  向氯化铝溶液中滴加氢氧化钠至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属Na、Mg、A1熔、沸点由高到低 | |
| B. | HC1、HBr、HI的还原性由弱到强 | |
| C. | H+、Li+、H-的半径由小到大 | |
| D. | 同浓度的硫酸钠、乙酸钠、碳酸钠溶液的碱性由强到弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | SO2具有漂白性,可使紫色石蕊试液褪为无色 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 在实验室里,常用电解饱和食盐水的方法制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应开始时速率:甲=乙 | B. | 反应所需时间:乙>甲 | ||
| C. | 参加反应时锌的质量:甲=乙 | D. | 两份酸溶液物质的量浓度:乙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
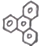 的一氯取代物有6种.
的一氯取代物有6种.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com