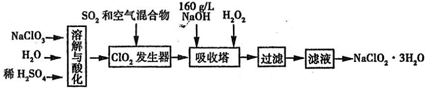
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验.
I、甲同学向1mol?L-氯化铁溶液中加入少量的NaOH溶液;II、乙同学直接加热饱和FeCl3溶液;III、丙同学向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热.根据你的理论和实践试回答下列问题:
(1)其中操作最可能成功的同学是______;他的操作中涉及到的化学反应方程式为______.
(2)设计最简单的办法确证有Fe(OH)3胶体生成,其操作及现象是:______则一定有Fe(OH)3胶体生成.
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明______.
②向其中加入硫酸铝,可观察到的现象是______.
解:(1)甲同学向1mol?L
-氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl
3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl
3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,原理是:FeCl
3+3H
2O

Fe(OH)
3(胶体)+3HCl,
故答案为:丙;FeCl
3+3H
2O

Fe(OH)
3(胶体)+3HCl (条件写成煮沸也可);
(2)胶体具有丁达尔效应:当光束通过胶体时,从侧面观察到一条光亮的“通路”,故答案为:用激光笔照射,有一条明亮的光路(则有胶体生成);
(3)①胶体具有电泳性质,电泳实验证明了胶体胶粒带点,胶粒向负极移动,说明Fe(OH)
3胶粒带正电,故答案为:Fe(OH)
3胶粒带正电;
②胶体具有聚沉的性质,向胶体中加入可溶性的盐、加热、搅拌等条件会使胶体聚沉,故答案为:生成红褐色的沉淀.
分析:(1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl
3饱和溶液,继续煮沸至溶液呈红褐色,停止加热;
(2)只有胶体具有丁达尔效应,可以验证胶体的产生;
(3)①交易的电泳实验证明了胶体胶粒是带电的;
②向胶体中加入可溶性的盐、加热、搅拌等条件会使胶体聚沉.
点评:本题考查学生胶体的性质,要求学生熟记教材知识,学以致用.

 Fe(OH)3(胶体)+3HCl,
Fe(OH)3(胶体)+3HCl, Fe(OH)3(胶体)+3HCl (条件写成煮沸也可);
Fe(OH)3(胶体)+3HCl (条件写成煮沸也可);