
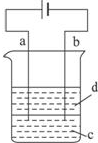
 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀.两电极的材料分别为石墨和铁.分析 (1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,a与电源正极相连,则a为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化;溶液中溶有空气,加热煮沸,排出溶液中的氧气;
(4)反接电源时,电解方程式是2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
解答 解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,b与电源正极相连,则b为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+FeCl2,
故答案为:BC;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对c溶液进行加热煮沸的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;
(4)反接电源时,电解方程式是2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.
点评 本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | |
| Y | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存在水中 | B. | 密封,保存在广口瓶中 | ||
| C. | 用铝箔包裹,密封在广口瓶中 | D. | 密封,保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  | [ 来源:] 来源:] |
| 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量 | 向醋酸溶液中逐滴加入等浓度的氨水至过量 | 向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量 | 向氨水中逐滴加入等浓度的盐酸至过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁不剩余,Cu剩余 | B. | 铜不剩余、铁剩余 | C. | 铁、铜均剩余 | D. | 铁、铜均不剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2为0.5mol•L-1,Y2为1.0mol•L-1 | B. | Y2为1.0mol•L-1 | ||
| C. | X2为0.5mol•L-1,Z为0.2mol•L-1 | D. | Z为0.6mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com