
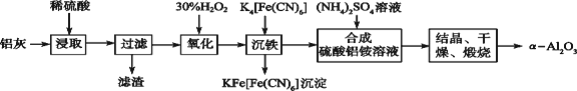
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下图:
(1)写出铝灰与氢氧化钠溶液反应涉及的化学方程式:_______________________。
(2)加30%H2O2溶液发生的离子反应方程式为______________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
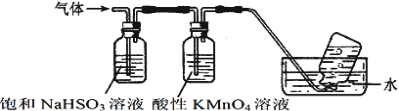
集气瓶中收集到的气体是_______(填化学式)。
②酸性KMnO4溶液紫色变浅_______(填“能”或“不能”)说明煅烧硫酸铝铵晶体产物中含有SO2气体?理由:______。
【答案】Al2O3+2NaOH+3H2O=2Na[Al(OH)4]、SiO2+2NaOH=Na2SiO3+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O N2 不能 饱和NaHSO3在吸收SO3的同时会也释放出SO2
【解析】
铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3)加稀硫酸,Al2O3、FeO、Fe2O3转化为离子,SiO2不溶于硫酸,过滤,滤液中含有Al3+、Fe2+、Fe3+,加双氧水,Fe2+被氧化为Fe3+,加入K4[Fe(CN)6],Fe3+转化为沉淀,过滤,在滤液中加入硫酸铵,生成NH4Al(SO4)2,结晶、干燥、煅烧得到α氧化铝;
(1)铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),Al2O3与氢氧化钠溶液反应生成偏铝酸钠和水,其反应的方程式为:Al2O3+2NaOH+3H2O=2Na[Al(OH)4];SiO2与氢氧化钠溶液反应生成硅酸钠和水,其反应的方程式为:SiO2+2NaOH=Na2SiO3+H2O,故答案为:Al2O3+2NaOH+3H2O=2Na[Al(OH)4];SiO2+2NaOH=Na2SiO3+H2O。
(2)滤液中含有Al3+、Fe2+、Fe3+,加30%的H2O2溶液Fe2+被氧化为Fe3+,其反应的离子方程式为: 2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)①[NH4Al(SO4)2·12H2O]分解生成的气体NH3和SO3被亚硫酸氢钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2;故答案为:N2;
②酸性KMnO4溶液紫色变浅不能说明煅烧硫酸铝铵晶体产物中含有SO2气体,因为饱和NaHSO3在吸收SO3的同时会也释放出SO2,故答案为:不能;饱和NaHSO3在吸收SO3的同时会也释放出SO2。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下图是制备和研究乙炔性质的实验装置图,有关说法不正确的是

A. 用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净
B. c(过量)的作用是除去影响后续实验的杂质
C. d、e中溶液褪色的原理不同
D. f处产生明亮、伴有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的相对分子质量为62。为进一步测定A 的化学式,取3.1g A完全燃烧,得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重2.7 g和4.4 g(假设每步反应完全)。
(1)该有机物的实验式是__________________;分子式是________________。
(2)红外光谱显示有“C—C”键和“O—H”键的振动吸收,若核磁共振氢谱只有2个吸收峰且峰面积之比为1∶2,推断该有机物的结构简式是__________________。
(3)该有机物与金属钠反应的化学方程式是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与对应的图象不相符的是( )
A. 向氢氧化钠溶液中滴加氯化铝 B. 向偏铝酸钠溶液中滴加盐酸至过量
B. 向偏铝酸钠溶液中滴加盐酸至过量 C. 向碳酸钠溶液中逐滴加入盐酸
C. 向碳酸钠溶液中逐滴加入盐酸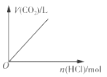 D. 向含有铝离子和镁离子的溶液中加入氢氧化钠至过量
D. 向含有铝离子和镁离子的溶液中加入氢氧化钠至过量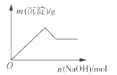
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将40g的锌粉和少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),则剩余锌粉的质量为( )
A. 1.0gB. 2.0gC. 2.5gD. 7.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是______杂化。
(2)C的氢化物的空间构型为________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________。
(3)B元素的电负性____D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________。(阿伏加德罗常数用NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
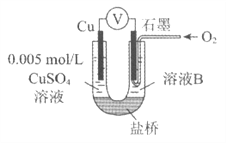
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是__________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com