
【题目】某化合物的化学式为(NH4)2Fe(SO4)2 ,它在水溶液里电离时生成两种阳离子和一种酸根离子
(1)写出硫离子的结构示意图________________;
(2)若向该化合物的水溶液中通入氯气,一种离子很容易被氧化,该离子将变成______;(用离子符号表示)
(3)若向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则该反应的离子方程式为__________________________。
【答案】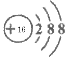
![]() 2NH3·H2O +Fe2+
2NH3·H2O +Fe2+![]() =2
=2![]() + Fe(OH)2↓
+ Fe(OH)2↓
【解析】
(1)根据硫离子的质子数和核外电子数写出离子的结构示意图;(2)根据氯气具有强氧化性、Fe2+具有还原性判断;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水.
(1)硫离子核内有16个质子,核外有18个电子,离子的结构示意图为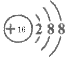 ;(2)氯气具有强氧化性、Fe2+化合价可升高,具有还原性,二者发生氧化还原反应生成Fe3+;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水,离子反应方程式为2NH3·H2O +Fe2+=2
;(2)氯气具有强氧化性、Fe2+化合价可升高,具有还原性,二者发生氧化还原反应生成Fe3+;(3)向该化合物的水溶液中加入过量一种碱溶液,只能发生一个离子反应,则所加入物质应含有铵根离子,为氨水,离子反应方程式为2NH3·H2O +Fe2+=2![]() + Fe(OH)2↓.
+ Fe(OH)2↓.


科目:高中化学 来源: 题型:
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是__________;
(2)即发生离子键破坏、又发生共价键破坏的是____________________;
(3)N2的电子式为__________;Na2O2的电子式为___________;CO2的电子式为_________;
(4)用电子式表示MgCl2的形成过程 _____________________;
(5)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436 kJ、946 k J、391 k J。则由N2和H2反应生成1 mol NH3 需要放出_____的热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硅、二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性。

用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂________(填序号)。
①10%的硫酸溶液 ②80%硫酸溶液 ③亚硫酸钠固体 ④亚硫酸钙固体
(2)写出装置B中发生反应的化学方程式: ______________________。
(3)你认为该装置的不足之处是_______________________________(任写2条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯(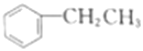 )是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
)是重要的化工原料,工业上利用乙苯可以制备苯乙烯和β-氯苯乙烷:
乙苯脱氢制苯乙烯:
![]() △H1=akJ/mol
△H1=akJ/mol
乙苯氯化制β-氯苯乙烷:
![]() △H2=bkJ/mol
△H2=bkJ/mol
回答下列问题:
(1)利用下表提供的数据计算a=_____。乙苯脱氢制苯乙烯的反应在_____(填“高温”或“低温”)有利于其自发进行。
化学键 | C-H | C-C | H-H | C=C |
键能/kJ/mol | 412 | 348 | 436 | 612 |
(2)已知
![]() +HCl(g)
+HCl(g)![]()
![]() △H=-54kJ/mol
△H=-54kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol 则b=______________。
(3)T℃,将nmol乙苯加入到体积为V L的恒容容器中,发生脱氢反应,容器内压强随时间变化如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
压强/×100 kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
平衡时容器内气体的总物质的量为______,乙苯的转化率为______%。
(4)工业由乙苯脱氢制苯乙烯实际上是在恒压密闭容器中进行的。将m mol乙苯通入某恒压密闭容器中(反应过程中维持压强为p),乙苯的平衡转化率随温度变化如右图所示:
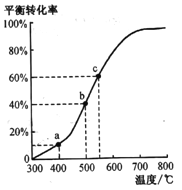
①在a点所示的条件下,向该容器中通入25L水蒸气,则乙苯的转化率______(填“变大”“变小”或不变),生成苯乙烯的速率________(填“变大”“变小”或不变)。
②b点气体总体积______(填“<”“>”或“=”)c 点气体总体积。
③c点平衡常数Kp=_______(用平衡分压代替平衡浓度,平衡分压=物质的量分数×总压)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6-硝基胡椒基酸K是合成心血管类药物米络沙星的中间体,在实验室中合成路线如下图所示(部分反应条件已经略去):
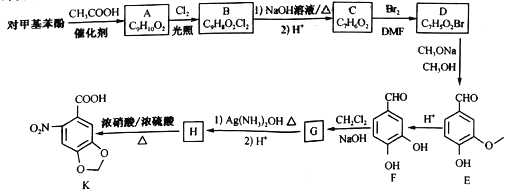
已知:连在同一个碳上的两个羟基易脱水形成羰基。
回答下列问题:
(1)C的名称为_______,H 中官能团的名称为__________。
(2)由C生成D的反应类型为_______,G 的结构简式为_______ 。
(3)由A生成B的化学方程式为_______ 。
(4)R是E的同分异构体,R中有两个取代基,其中一个为羟基且与苯环直接相连,另一个取代基含有“![]() ”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
”,符合条件的R有_____种。其中核磁共振氢谱显示有5种不同类型的氢,且峰的面积之比为2 :2 :2: l: 1的同分异构体的结构简式为________。
(5)写出以邻苯二酚![]() 和乙醇为原料制备
和乙醇为原料制备![]() 的合成路线____________(其他无机试剂任选)。
的合成路线____________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,利用回收的某酸性锌锰干电池,处理可得到多种化工原料,并制备ZnSO4·7H2O。经查询该电池一种一次性电池,外壳为金属锌铁合金,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的填充物,放电过程产生MnOOH。
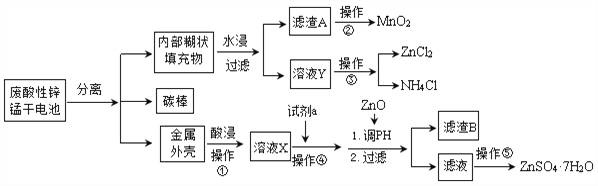
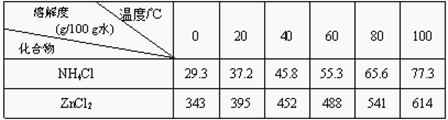
已知:Ksp(Zn(OH)2)=10-17;Ksp(Fe(OH)3)=10-39;![]()
![]() = 4.64 lg2 = 0.3
= 4.64 lg2 = 0.3
回答下列问题:
(1)操作①的酸浸选用的酸为__________(填化学式),溶液X含有的阳离子为_________。
(2)滤渣A进行操作②得到较纯的MnO2,最简便的方法为__________,其原理是________。
(3)操作③和操作⑤,可通过__________、过滤、洗涤、晾干等步骤,分离提纯得到产品。
(4)操作④选用的试剂a选用___________(填化学式),其目的是______________________________(用离子方程式表示),继续加 ZnO调节pH,生成氢氧化铁沉淀,铁刚好沉淀完全的pH约为________ (离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,不能大量共存的离子组是( )
A.Cu2+、Na+、SO42﹣、Cl﹣
B.K+、Na+、HCO3﹣、NO3﹣
C.OH﹣、HCO3﹣、Ca2+、Na+
D.Ba2+、Na+、OH﹣、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com