
用消石灰与Cl2反应制漂白粉,假定消石灰100%转化为漂白粉。某游泳池消毒一次需要4.26 kg Cl2,现改用上述漂白粉,假定起消毒作用的是HClO,要达到与Cl2相当的消毒效果,需向游泳池中投放这种漂白粉多少千克?
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
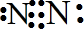
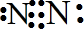
| ||
| ||
 ②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
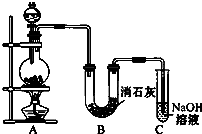 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:查看答案和解析>>
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:038
工业上用纯净的消石灰与Cl2反应制取漂白粉.已知漂白粉的有效成分为55.17%,求消石灰的利用率.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com