
【题目】含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46kJ的热量,表示该反应的中和热的热化学方程式为
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46 kJ·mol-1
C.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) △H=-57.3 kJ·mol-1
D.2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-114.6 kJ·mol-1
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
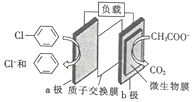
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳单质在工业上有多种用途。例如焦炭可用来制取水煤气、冶炼金属,活性炭可处理大气污染物NO。一定条件下,在2 L密闭容器中加入NO和活性炭(无杂质)反应生成气体A和B。当温度在T1 ℃时,测得各物质平衡时物质的量如下表:
活性炭(mol) | NO(mol) | A(mol) | B(mol) | |
初始 | 2.030 | 0.100 | 0 | 0 |
平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
在T1 ℃时,达到平衡共耗时2分钟,则NO的平均反应速率为________ mol·L-1·min-1;当活性炭消耗0.015 mol时,反应的时间________(填“大于”、“小于”或“等于”)1分钟。
(2)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
CH3OH(g)+H2O(g) ΔH<0。某科学实验小组将6 mol CO2和8 mol H2充入一容积为2 L 的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:

①该反应在0~8min时,CO2的转化率是________。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。a、b、c、d四点中逆反应速率大小关系为_________,M、b、N三点中平衡常数K的大小关系是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。
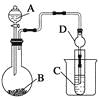
(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe2O3、Al2O3、FeO、SiO2)制备绿矾(FeSO47H2O)的流程如下:
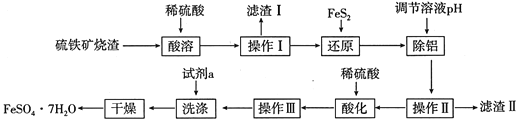
已知:①FeS2难溶于水,能还原Fe3+,硫元素被氧化成SO42-。
②金属离子生成氢氧化物沉淀的pH范围见下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.5 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 6.3 | 8.3 |
(1)滤渣Ⅰ的主要成分可与某种酸反应,其气态产物的电子式为____________;滤渣Ⅱ经灼烧后可用于_______(写出一种用途即可)。
(2)“还原”的目的是__________,写出“还原”步骤中涉及反应的离子方程式_________。
(3)“除铝”反应过程中控制的pH范围是_______________________。
(4)操作Ⅲ包含3个基本的实验操作,依次是_______________,“洗涤”时的试剂最好选用下列中的____________(填代号)
A.热水 B.氯水 C.乙醇 D.饱和食盐水
(5)设计实验检验制得的绿矾晶体中是否含有Fe3+:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
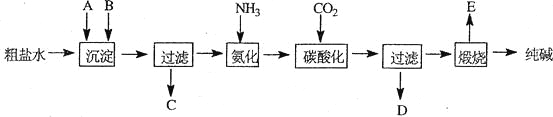
【题目】工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A__________________________________B__________________________________
(2)实验室提纯粗盐的实验操作依次为:
取样、______、沉淀、______、______、冷却结晶、______、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是____________________________。
碳酸化时没有析出碳酸钠晶体,其原因是_______________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是_____________________________(填写化学式),检验这一成分的阴离子的具体方法是:________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:_________________________________________________________
滤液D加石灰水前先要加热,原因是_____________________________________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
_____________________________________________________________________________
(注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式为:
①H2(g)+![]() O2(g)=H2O(l) △H=-285.8 kJ·mol-1
O2(g)=H2O(l) △H=-285.8 kJ·mol-1
②H2(g)=H2(l) △H=-0.92 kJ·mol-1
③O2(g)=O2(l) △H=-6.84 kJ·mol-1
④H2O(l)=H2O(g) △H=+44.0kJ·mol-1
则反应H2(l)+![]() O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
O2(l)=H2O(g)的反应热△H与△H1、△H2、△H3、△H4的关系正确的是为
A.△H=△H1+△H2+△H3+△H4
B.△H=△H1-△H2-△H3+△H4
C.△H=△H1+△H2+![]() △H3+△H4
△H3+△H4
D.△H=△H1-△H2-![]() △H3+△H4
△H3+△H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 molL﹣1s﹣1B.v(B)=0.3molL﹣1s﹣1
C.v(C)=0.8 molL﹣1s﹣1D.v(D)=1 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是
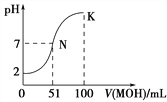
A. MOH为一元强碱
B. K点对应的溶液中:c(M+) + c(MOH) = c(A-)
C. K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol·L-1
D. N点水的电离程度小于K点水的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com