
����Ŀ�������ܼ��еĵ���ʵ�������е�H+ת�Ƹ��ܼ����ӣ���HCl+H2O=H3O++Cl�� �� ��֪H2SO4��HNO3�ڱ������еĵ���ƽ�ⳣ��Ka1��H2SO4��=6.3��10��9 �� Ka��HNO3��=4.2��10��10 �� ����˵����ȷ���ǣ� ��
A.��������H2SO4�ĵ��뷽��ʽ��H2SO4+2CH3COOH=SO42��+2CH3COOH2+
B.H2SO4�ı�������Һ�У�c��CH3COOH2+��=c��HSO4����+2c��SO42����+c��CH3COO����
C.Ũ�Ⱦ�Ϊ0.1mol?L��1��H2SO4��HNO3�ı�������Һ��pH��H2SO4����pH��HNO3��
D.��HNO3�ı�������Һ�м�������ᣬ ![]() ��С
��С
���𰸡�B
��������A����������H2SO4�������ֵ��룬�ֲ����룬�Ե�һ������Ϊ�������������H2SO4�ĵ��뷽��ʽ��H2SO4+CH3COOHHSO4��+CH3COOH2+ �� ��A����
B��H2SO4�ı�������Һ�д��������غ㣺c��CH3COOH2+��=c��HSO4����+2c��SO42����+c��CH3COO��������B��ȷ��
C���ڱ������е���ĵ���ƽ�ⳣ��Խ�������������Ũ��Խ��pHԽС������ĵ��볣��������H2SO4��������Ũ�ȴ���pH��H2SO4����pH��HNO3������C����
D����HNO3�ı�������Һ�м�������ᣬ��Һ�����������c��NO3������С�����볣��Ϊ 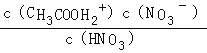 �dz���������
�dz��������� 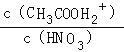 ����D����
����D����
��ѡB��
�����㾫����ͨ������������������ˮ��Һ�еĵ���ƽ�⣬���յ�������ʷ����������ӵ����ʵ��ڽ�ϳɷ��ӵ�����ʱ��������ʵĵ���ʹ��ڵ���ƽ��״̬������ƽ���ǻ�ѧƽ���һ�֣�ͬ�����л�ѧƽ��������������ı�ʱƽ���ƶ��Ĺ��ɷ�����ɳ����ԭ�������Խ����⣮


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�죮ʵ���� 70��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
A.ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B.ͼ�ұ���������������ͬʱ����ҺpHԽС��H2O2�ֽ�����Խ��
C.ͼ������������Mn2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D.ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ���ǣ� ��
A. ��ѧ���Ķ��Ѻ��γ��ǻ�ѧ��Ӧ�����仯����Ҫԭ��
B. ��ѧ���������е��ʺͻ�������
C. ���й��ۼ��Ļ����ﲻһ���ǹ��ۻ�����
D. N2�����к��еĹ��ۼ���ǿ����N2���ӱȽ��ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҽѧԺ�з���һ�����͵IJ���ҩƷ����ҩƷ����Ч�ɷ�������������������ɫ��������ˮ��������HCl����Ϊ�˼���ҩƷ�е�Fe2+ �� ijѧϰС���������ͼʵ�鲽�裺 
��1��A��Һ�����ʵĻ�ѧʽ�� �� ����A��Һ���ȼ���������ˮ�Ͳ���dz��ɫ��ԭ���� �� ����������ˮ֮��ı仯�����ӷ���ʽ��ʾ�� �� �����Fe3+ �� ��Һ���Ѫ��ɫ��
��2�����ɵ�Ѫ��ɫ��Һ����ʱ���������������ɫ����ͬѧ������Fe3+����ԭ��Fe2+������ɫ��֤����ͬѧ�IJ��벻������ʵ�������ȡ������ɫ��Һ���μ� �� �۲쵽����֤����
��3����ͬѧΪ���ҩƷ��Fe�ĺ�������Ʋ�����������ʵ�飺 ��ȡ�������飬��ȷ��ȡ2.0g������������ᣬ����ʹ����ȫ�ܽ⣻
����������Һ�м������H2O2��Һ���ټ��백ˮ�����ٲ���������
�۽����ù������������أ��õ�0.8g�����ĺ���ɫ��ĩ��
���ҩƷ��������������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������л���ˮ�ݣ���ò������к��ַ�������( )
A. ���� B. ���� C. ��Һ D. ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������ص��ǣ� ��
A. NH3���Ӽ�������ˮB. ˮ��ɱ�������ͣ��ܶȱ�С
C. ˮ���ȵ��ܸߵ��¶ȶ����Էֽ�D. ˮ�ķе��H2S�ķе��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��̼���⡢������Ԫ����ɣ���ȡ3g A��4.48L����״�����������ܱ������г��ȼ�գ����ɶ�����̼��һ����̼��ˮ���������跴Ӧ��û��ʣ�ࣩ������Ӧ���ɵ���������ͨ��Ũ����ͼ�ʯ�ҳ�����գ�Ũ��������3.6g����ʯ������4.4g��ʣ���������Ϊ1.12L����״�������ش��������⣺
��1��3g Aȼ�պ�����������ʵ����ֱ�Ϊ��n��H2O��= �� n��CO2��= �� n��CO��= ��
��2��ͨ������ȷ��A�ķ���ʽ��
��3��д��A��һ�ֿ��ܵĽṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ļ���ԭ�ϣ���;�㷺��
��1���ϳɰ��������ô��������ͭ����[Cu��NH3��2]+��CH3COO�����ɣ���Һ���ն��ϳɴ����ж�����CO���壮
�ٴ��������ͭ������Ԫ���У���һ������������ ��
�ڴ��������ͭ����Ԫ�صĵ��ʣ������ľ���������������ţ���
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
�۵�4�����У���̬ԭ�����̬Cuԭ��δ�ɶԵ�����Ŀ��ͬ��Ԫ�����֣�����Cu����
��ͭ����Ϊ�����������壬�侧���߳�a nm����ʽ��ʾͭ���ʵ��ܶ� gcm��3 ��
��2��BF3������NH3������������һ�ְ�ɫ���壺BF3+NH3=F3B��NH3 ��
�پ���F3B��NH3�У�Bԭ�ӵ��ӻ��������Ϊ ��
��д��������BF3������ͬ�ռ乹�͵��������� ��
��3��NH3�����ںϳ����ء�����淋ȵ��ʣ�ij���ʳ���������������м��һ�����ΪN4H4��SO4��2�����ʣ���������ˮ��Һ����SO42����N4H44+�����������幹�͵����Ӵ��ڣ�N4H44+��������һ�����ư���N4���ӣ�
���������˵���У���ȷ����������ţ���
a��N4��N2��ͬ���칹��
b��1mol N4�ֽ�����N2 �� �γ���4mol �м�
c�����ķе��N4�ߣ�����ΪP��P�����ܱ�N��N����
d�����Ļ�ѧ���ʱ�N2���ã�˵��P�ķǽ����Ա�Nǿ
�ڻ���N4H44+�Ľṹ���������е���λ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����C��H��O����Ԫ����ɣ��������ģ����ͼ��ʾ�����ڸ��л���������ȷ���ǣ� ��
A.����ʽΪC11H9O3
B.����ʹ��ˮ��ɫ
C.���ڷ����廯����
D.������Na0H��Һ��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com