
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
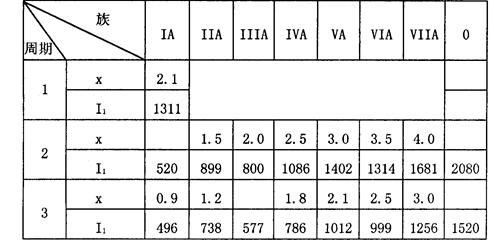
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
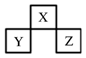
| A.原子半径的大小为:Z>Y>X |
| B.若Y的氧化物为两性氧化物,则X、Z分别形成单质的微观结构中均可能具有正四面体构型 |
| C.若X的氢化物与Z的最高价氧化物对应水化物能反应,则生成的盐仅有一种 |
| D.若Y与Z的核电荷数之和为X的4倍,则X、Z形成的对应氢化物的熔沸点前者高于后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
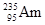 ,它和铀
,它和铀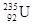 比较,下列叙述中正确的是
比较,下列叙述中正确的是| A.它们互为同位素 | B.原子核内的中子数相同 |
C.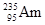 比 比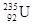 多3个中子 多3个中子 | D.具有相同的质量数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
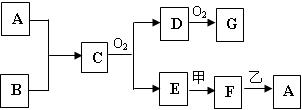
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Na+的电子排布图: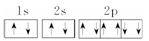 |
| B.Na原子的简化电子排布式:[ Na ] 3s1 |
C.钾原子的基态原子结构示意图为: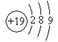 |
D.H2O电子式为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.元素 的原子半径随元素原子序数的递增呈周期性变化 的原子半径随元素原子序数的递增呈周期性变化 |
| B.同周期元素随着原子序数的递增,元素的原子半径自左到右逐渐减小 |
| C.同主族元素随着原子序数的递增,元素的原子半径自上而下逐渐增大 |
| D.电子层数相同时,有效核电荷数越大,对外层电子的吸引作用越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com