
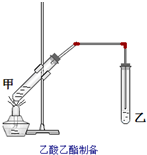
 如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:| 1 |
| 3 |
| 1 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| Y | ||
| Z |
| A、Y元素原子的外围电子排布为4s24p4 |
| B、Y元素在周期表的第三周期ⅥA族 |
| C、X元素所在周期中所含非金属元素最多 |
| D、Z元素的最高正价为+5价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤ | B、①③ | C、仅有③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤⑦ | B、②③⑥⑧ |
| C、①⑤⑨ | D、③⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 相对分子质量 | 密度/g?cm-3 | 水溶性 | 沸点/℃ |
| 甲酸 | 46 | 1.22 | 与水混溶 | 100.8 |
| 甲醇 | 32 | 0.79 | 与水混溶 | 64.7 |
| 甲酸甲酯 | 60 | 0.98 | 与水不互溶 | 32.0 |
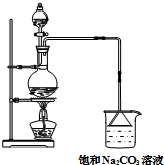 同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:
同学们认为课本中酯化反应的装置有很多缺点,进行了部分改进,如图所示,进行制备甲酸甲酯的实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
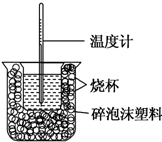 已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:
已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用如图装置进行中和热的测定,请回答下列问题:| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 15.0 | 18.4 | △H1 |
| HCl+NH3?H2O | 15.0 | 18.1 | △H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,17g甲基(-14CH3)所含的中子数为8NA |
| B、64g的铜发生氧化还原反应,一定失去2 NA个电子 |
| C、常温常压22.4LNO气体的分子数为NA |
| D、标况时,22.4L三氯甲烷所含有的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com