
| A. | 0.4Q1+0.1Q3+0.1 Q2 | B. | 0.4 Q1+0.05 Q2+0.1 Q3 | ||
| C. | 0.4 Q1+0.1 Q3-0.05 Q2 | D. | -0.4 Q1-0.05 Q2-0.1 Q3 |
分析 已知①2H2(g)+O2(g)=2H2O(g);△H2=-Q2 kJ•mol-1,②H2O(l)=H2O(g);△H3=Q3 kJ•mol-1,利用盖斯定律将①-2×②可得2H2(g)+O2(g)=2H2O(l);△H2=(-Q2-2Q3)kJ•mol-1,又知CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H1=-Q1kJ•mol-1,可结合热化学方程式计算体积比4:1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温放出的热量.
解答 解:甲烷和氢气的混合气体11.2L(已折合成标准状况),所以甲烷和氢气的混合气体的总的物质的量为n=$\frac{V}{Vm}$=$\frac{11.2L}{22.4L/mol}$=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1=-Q1kJ•mol-1可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)=2H2O(l) △H2=(-Q2-2Q3)kJ•mol-1可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×$\frac{1}{2}$×(-Q2-2Q3)kJ•mol-1=(-0.05 Q2-0.1 Q3)kJ;
则放出的热量为-0.4 Q1-0.05 Q2-0.1 Q3,
故选D.
点评 本题考查热化学反应方程式的计算,为高频考点,把握物质的量与热量的关系为解答的关键,侧重分析与计算能力的考查,注意常温下水为液态,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | MnO2 与浓盐酸反应制 Cl2:MnO2+4HCl═Mn2++2Cl-+CI2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | Ca(HCO3)2 溶液与少量 NaOH 溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 明矾溶于水产生 Al(OH)3胶体:Al3++3H2O═Al(OH)↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲中铜片表面产生气泡 | |
| B. | 装置甲中正极的电极反应式:2H++2eˉ=H2↑ | |
| C. | 装置乙中电流从铜片经导线流向锌片 | |
| D. | 装置乙溶液中SO42ˉ向铜片做定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )
为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如图所示.下列叙述中正确的是( )| A. | 该物质可以视为酚类 | |
| B. | 在浓硫酸作用下,分子内消去一个水分子,产物有三种同分异构体 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
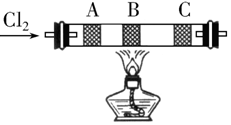 在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.
在硬质玻璃管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉(已知淀粉遇I2显蓝色)溶液的3个棉球(如图所示).由左端通入氯气,在B处加热,可观察到A处棉球呈橙色,B处棉球呈现黄色,C处棉球呈蓝色.将玻璃管冷却后,在B、C之间的玻璃壁上有紫黑色的固体(填物质状态),这是因为碘易升华.A、B两处发生的离子方程式分别是:Cl2+2Br-=Br2+2Cl-、Cl2+2I-=I2+2Cl-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )
锌银(Zn-Ag2O)电池多应用于军事、航空、移动的通信设备、电子仪器和人造卫星、宇宙航行等方面,用如图所示装置模拟其工作原理,下列说法正确的是( )| A. | K+向a极移动 | |
| B. | b 极的电极反应式为 Ag2O+H2O+2e-═2Ag+2OH- | |
| C. | 用该电池给铁棒镀铜,则铁棒与 b 极相连 | |
| D. | 电池工作一段时间后,电解液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com