
分析 (1)①0.1mol•L-1的醋酸,醋酸为弱电解质,部分电离,0.1mol•L-1的醋酸氢离子浓度小于0.1mol•L-1;
②0.1mol•L-1的硫酸,硫酸为强电解质0.1mol•L-1的硫酸,氢离子浓度为 0.2mol•L-1;
③0.1mol•L-1的氨水,一水合氨为弱电解质,部分电离,0.1mol•L-1的氨水氢氧根离子浓度小于0.1mol•L-1;
④0.1mol•L-1的NaOH溶液,氢氧化钠为强电解质,完全电离,0.1mol•L-1的NaOH溶液中氢氧根离子浓度0.1mol•L-1;
溶液中氢离子浓度越大,溶液PH越小,氢氧根离子浓度越大溶液PH越大;
(2)水溶液中或熔融状态下能导电的化合物为电解质,在溶液中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质,水溶液中和熔融状态下都不导电的化合物为非电解质;
(3)加水稀释弱酸时,会促进弱酸的电离;依据中和反应中消耗的氢离子的物质的量等于氢氧根离子的物质的量解答;
(4)根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步电离出的氢离子抑制第二步电离;
(5)设酸溶液的pH为a,碱溶液的pH为b,根据酸碱中和反应氢离子物质的量和氢氧根离子物质的量相同列式计算.
解答 解:(1)①0.1mol•L-1的醋酸,醋酸为弱电解质,部分电离,0.1mol•L-1的醋酸氢离子浓度小于0.1mol•L-1;
②0.1mol•L-1的硫酸,硫酸为强电解质0.1mol•L-1的硫酸,氢离子浓度为 0.2mol•L-1;
③0.1mol•L-1的氨水,一水合氨为弱电解质,部分电离,0.1mol•L-1的氨水氢氧根离子浓度小于0.1mol•L-1;
④0.1mol•L-1的NaOH溶液,氢氧化钠为强电解质,完全电离,0.1mol•L-1的NaOH溶液中氢氧根离子浓度0.1mol•L-1;
碱溶液PH大于酸溶液,溶液中氢离子浓度越大,溶液PH越小,溶液PH②<①,氢氧根离子浓度越大溶液PH越大,③<④,
则其pH由小到大的顺序是②①③④,
故答案为:②①③④;
(2)①NaCl溶于水或熔融状态导电,完全电离为强电解质;
②BaSO4 熔融状态导电完全电离,属于强电解质;
③稀硫酸是硫酸的溶液,是混合物;
④KOH 水溶液中或熔融状态下导电,完全电离,属于强电解质;
⑤H2O存在电离平衡导电,属于弱电解质;
⑥CH3COOH水溶液中存在电离平衡,属于弱电解质;
⑦NH3本身不能电离出离子,水溶液中反应生成电解质一水合氨,氨气属于非电解质;
⑧蔗糖水溶液中和熔融状态下本身不能电离出离子,属于非电解质;
⑨SO2本身不能电离出离子,水溶液中反应生成电解质亚硫酸,二氧化硫属于非电解质;
⑩Cu是单质.既不是电解质也不是非电解质,
其中属于强电解质的有①②④,其中属于弱电解质的有⑤⑥,属于非电解质的有⑦⑧⑨,
故答案为:①②④,⑤⑥,⑦⑧⑨;
(3)某一元弱酸溶液(A)与二元强酸(B)的pH相等,则弱酸有大部分为电离,加水稀释时,能够促进更多的弱酸电离,所以加水稀释后,氢离子浓度大于二元强酸中氢离子浓度,所以pHA<pHB,
上述稀释溶液中弱酸的氢离子的物质的量浓度大于强酸,所以等体积含有的氢离子的物质的量多,中和等浓度等体积的NaOH溶液,用的体积少,
故答案为:<,<;
(4)根据电离方程式知,HA-只电离不水解,0.1mol•L-1NaHA溶液的pH=2,则HA-电离出氢离子浓度为0.01mol/L,H2A第一步完全电离生成0.1mol/L的氢离子,第一步电离出的氢离子抑制第二步电离,所以第二步电离出的氢离子浓度小于0.01mol/L,则H2A溶液中氢离子的物质的量浓度应小于0.11mol/L,
故答案为:<;H2R中第一步电离出的H+对HR-的电离产生了抑制作用;
(5)设强酸溶液的pH为a,体积为V,pH=-lgc(H+),溶液中氢离子浓度为:10-amol/L;碱溶液的pH为b,体积为10V,溶液中氢氧根离子的浓度为:c(OH-)=10-(14-b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量等于氢氧根离子的物质的量,即10-amol/L×VL=10-(14-b)mol/L×10VL,
解得:-a=b-13,a+b=13,即pH酸+pH碱=13,
故答案为:pH酸+pH碱=13;
点评 本题考查了离子浓度大小的比较,电解质、强电解质、非电解质的判断,溶液酸碱性与pH值的相关计算,题目综合性强,设计内容多,难度中等,解题时注意把握电解质强弱的判断依据,注意弱电解质电离的特点.


科目:高中化学 来源: 题型:选择题
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CO2中混有的HCl:将气体通过饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用金属钠时,所需用品至少有小刀、镊子、滤纸、玻璃片 | |
| B. | 金属钠与Ca(HCO3)2溶液反应时,既有白色沉淀又有气体逸出 | |
| C. | 生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl | |
| D. | Na2O2与碱反应生成盐和水,所以Na2O2是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2作正极,电极发生氧化反应 | |
| B. | 当转移的电子数为3.01×1023时,参与反应的Pb的质量为103.5 g | |
| C. | 负极的电极反应式是:Pb+SO42--2e-═PbSO4 | |
| D. | 溶液中H+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 如果某化学反应的△H和△S均小于0,则反应一定能自发进行 | |
| C. | 化学反应过程中,一定有化学键的断裂和形成 | |
| D. | 所有的吸热反应一定要在加热的条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
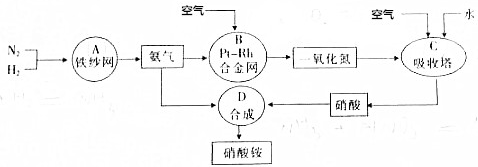
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
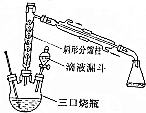 | 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水的溶解性 |
| 乙醇 | 46 | 0.789 | 78.3 | 溶 | |
| 乙酸 | 60 | 1.050 | 117.9 | 溶 | |
| 乙酸乙酯 | 88 | 0.896 | 77.2 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
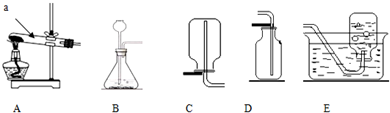
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com