
| A. | 常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol•L-1 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.在含Cl-、CrO42-浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 | |
| C. | 温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 | |
| D. | 实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
分析 A.铝粉可与非氧化性酸或强碱反应生成氢气,酸碱抑制水的电离;
B.假设浓度都为0.1mol/L,析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$mol/L,c(Ag+)越小,先生成沉淀;
C.溶液的导电性与离子浓度有关;
D.硝酸根离子在酸性条件下具有强氧化性.
解答 解:A.铝粉可与非氧化性酸或强碱反应生成氢气,而酸、碱都抑制水的电离,则溶液中水电离的c(H+)一定小于10-7mol•L-1,故A正确;
B.假设浓度都为0.1mol/L,析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.1}$=1.56×10-9mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{O}_{4}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.1}}$=3×10-5.5mol/L;c(Ag+)越小,故AgCl先出现沉淀,故B错误;
C.溶液的导电性与离子浓度有关,与电解质的强弱无关,因浓度未知,则不能确定电解质的强弱,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,与锌反应不生成氢气,应加入硫酸铜,故D错误.
故选A.
点评 本题综合考查弱电解质的电离以及难溶电解质的溶解平衡,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握难溶电解质的平衡特点以及影响因素,易错点为B,注意溶度积的相关计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L CHCl3 中含有的分子数为 0.5NA | |
| B. | 1mol H218O 中含有的中子数为 10NA | |
| C. | 46g C2H5OH 中含有的共价键数目为 7NA | |
| D. | 1L 1mol/L CH3COONa 溶液中含 CH3COO-的数目为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
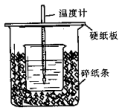 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z | |
| B. | X、Y 均能与W形成的离子化合物 | |
| C. | Z、W的气态氢化物的稳定性:Z>W | |
| D. | X、Z的最高价氧化物的水化物酸性:X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子比例模型: | |
| B. | 原子核内有18个中子的原子:${\;}_{17}^{35}$Cl | |
| C. | 1,2-二溴乙烷的结构简式:C2H4Br2 | |
| D. | 过氧化氢电子式: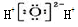 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:25 | B. | 1:7 | C. | 1:6 | D. | 2:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com