
实验室模拟合成氨和氨催化氧化的流程如下:


已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气______________、氢气______________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、_________。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸,原因是______________________________________________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是____________________________________________,
锥形瓶中还可观察到的现象是________________________________________________。
(5)写出乙装置中氨氧化的化学方程式:____________________________________
________________________________________________________________________。
(6)反应结束后锥形瓶内的溶液中含有的离子为H+、OH-、________、________。
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是( )
A.硫黄矿制备硫酸经历两步:S SO3
SO3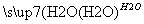 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2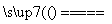 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的  ,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。
请回答下列问题:
(1)B单质的电子式是________。
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为____________________________。
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组同学设计如下图所示装置探究氨气的还原性。
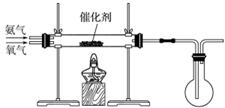
(1)氨催化氧化的化学方程式为_______________________________________________。
(2)若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为__________。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合适的方案并说明原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是____________,a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式_____________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________________________________________________________________________。
(4)写出E中发生反应的化学方程式
________________________________________________________________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的铁和足量的稀硝酸或浓硝酸完全反应,在相同条件下,用排水集气法收集产生的气体。下列叙述一定正确的是( )
①硝酸浓度越大,消耗的硝酸越少
②硝酸浓度不同,生成的Fe(NO3)3的物质的量相同
③硝酸浓度越大,产生的气体越少
④用排水集气法收集到的气体在相同状况下体积相同
A.只有② B.②④
C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
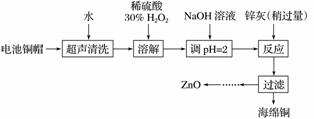
(1)①铜帽溶解时加入H2O2的目的是________________________________________________________________________
(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是________________________________________________________________________。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为
①________________________________________________________________________;
②________________________________________________________________________;
③过滤;
④________________________________________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的表述正确的是( )
A.离子结构示意图 :可以表示16O2-,也可以表示18O2-
:可以表示16O2-,也可以表示18O2-
B.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
C.氯化铵的电子式为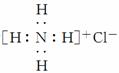
D.CO2的结构式为O—C—O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com