
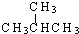 和
和  ②
② 和
和 
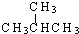 和
和  结构相似,分子组成相差1个“CH2”,故互为同系物;
结构相似,分子组成相差1个“CH2”,故互为同系物; 和
和  分子式相同,但结构不同,故互为同分异构体;
分子式相同,但结构不同,故互为同分异构体;

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性大于Y |
| W | W的一种核素的质量数为23,中子数为12 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、16.7% | B、50% |
| C、66.7% | D、83.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com