
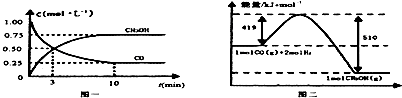
| ���� | ��Ӧ��Ͷ����� | ��Ӧ��� ת���� | CH3OH��Ũ�� | �����仯 ��Q1��Q2��Q3������0�� |
| �� | 1mol CO��2mol H2 | ��1 | c1 | �ų�Q1kJ���� |
| �� | 1mol CH3OH | ��2 | c2 | ����Q2kJ���� |
| �� | 2mol CO��4mol H2 | ��3 | c3 | �ų�Q3kJ���� |
���� I����֪����2CO��g��+O2��g���T2CO2��g������H=-566kJ•mol-1
��2Fe��s��+$\frac{3}{2}$O2��g���TFe2O3��s������H=-825.5kJ•mol-1
���ݸ�˹���ɣ��١�$\frac{3}{2}$-�ٿɵã�Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g�����ʱ�Ҳ������Ӧ���㣻
��1����ƽ��ʱCO�����ʵ����仯Ϊnmol����ʾ��ƽ��ʱCO��CO2�����ʵ�������ѧ����������1���������ʵ�������Ũ�ȴ���ƽ�ⳣ������n��ֵ����������CO��Ũ�ȱ仯����������ת���ʶ������CO��ת���ʣ�
��2�����CO��ƽ��ת���ʣ�Ӧʹƽ��������Ӧ�ƶ�������������CO�����������ѡ�����ƽ���ƶ�ԭ��������
��1������ͼ���м״�Ũ�ȱ仯�����������Ũ�ȱ仯�����ٸ���v=$\frac{��c}{��t}$���������ķ�Ӧ���ʣ�
��2��������Ϊ��ȫ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ�Ũ�ȡ����ʵ�����������ȣ�����ת���ʱ�ʾ�ס�����CO�����ʵ���������CO���ʵ�������жϦ�1����2��
��ƽ��ʱCO�����ʵ���Ϊnmol��CO��g��+2H2��g��?CH3OH��g���ķ�Ӧ�ȡ�H=-QkJ/mol����ʾ��ƽ��ʱ�ס�������������Q1��Q2���ݴ˼����жϣ�
�������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2��ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף�
��3����ƽ��ʱ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6����˵�����������С����Ӧ������У�
��4��ԭ��ظ�������������Ӧ���״��ڸ���ʧȥ���ӣ���������������̼���������ˮ��
��� �⣺I����֪����2CO��g��+O2��g���T2CO2��g������H=-566kJ•mol-1
��2Fe��s��+$\frac{3}{2}$O2��g���TFe2O3��s������H=-825.5kJ•mol-1
���ݸ�˹���ɣ��١�$\frac{3}{2}$-�ٿɵã�Fe2O3��s��+3CO��g��?2Fe��s��+3CO2��g�������H=��-566kJ•mol-1����$\frac{3}{2}$-��-825.5kJ•mol-1��=-23.5kJ•mol-1��
�ʴ�Ϊ��-23.5��
��1����ƽ��ʱCO�����ʵ����仯Ϊnmol����
$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g��
��ʼ��mol����1 1
�仯��mol����n n
ƽ�⣨mol����1-n n+1
����$\frac{n+1}{1-n}$=4�����n=0.6����CO��ƽ��ת����Ϊ$\frac{0.6mol}{1mol}$��100%=60%��
�ʴ�Ϊ��60%��
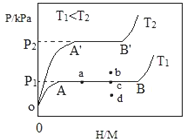
��2��a���÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ����߷�Ӧ�¶ȣ�ƽ�����淴Ӧ�ƶ���CO��ƽ��ת���ʽ��ͣ���a����
b����Ӧǰ����������ʵ������䣬����ѹǿƽ�ⲻ�ƶ���CO��ƽ��ת���ʲ��䣬��b����
c��������ʵĴ�����ƽ�ⲻ�ƶ�����c����
d���Ƴ�����CO2��ƽ��������Ӧ�ƶ���CO��ƽ��ת��������d��ȷ��
e�������ʯ��ʹ����ƽ���������ֽӴ���ƽ�ⲻ�ƶ�����e����
�ʴ�Ϊ��d��
��1����ͼ��֪���ﵽƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L�����c��H2��=2��0.75mol/L=1.5mol/L��v��H2��=$\frac{1.5mol/L}{10min}$=0.15mol/��L•min����
�ʴ�Ϊ��0.15mol/��L•min����
��2��A���ס�������ȫ��Чƽ�⣬ƽ��ʱ����ֵ�Ũ����ȣ�����ƽ��ʱ�״���Ũ��c1=c2����A��ȷ��
B���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2��ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף����вμӷ�Ӧ��CO���ڼ��е�2������2Q1��Q3����B����
C���������ȣ���ЧΪ�ڼ�ƽ��Ļ������ټ���1mol CO��2mol H2��ѹǿ����ƽ��������Ӧ�����ƶ������з�Ӧ���ת���ʴ��ڼף��ʦ�1����3 ����2��1�٦�3����C����
D������������ȫ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵĺ�����ȫ��ͬ��CO��ת����Ϊ��1����ƽ��ʱCO�����ʵ���Ϊ��1-��1��mol������ƽ��ʱ�״���ת����Ϊ��2������ƽ��ʱCO�����ʵ���Ϊ��2mol���ʣ�1-��1��=��2�������æ�1+��2=1����D��ȷ��
E����ƽ��ʱCO�����ʵ���Ϊnmol��CO��g��+2H2��g��?CH3OH��g���ķ�Ӧ�ȡ�H=-QkJ/mol����Q1=��1-n��Q��Q2=nQ��������Q=Q1+Q2����1mol CH3OH����ų���Q1+Q2��kJ��������E��ȷ��
�ʴ�Ϊ��ADE��
��3����ƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6����˵�����������С����Ӧ������У�
�ʴ�Ϊ������
��4��ԭ��ظ�������������Ӧ���ϳ��ڸ���ʧȥ���ӣ���������������̼���������ˮ�������缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
���� �����ۺϿ����˻�ѧƽ����㡢��Чƽ�⡢�绯ѧ֪ʶ�ȣ����е�Чƽ��ļ��㣬Ϊ������ѵ㣬Ҳ���״��㣬ע�������Чƽ�����⣬��Ŀ˼ά����ѧ�������������кܸߵ�Ҫ���ѶȺܴ�


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ͻ�������Ͼ�����������������ܣ���������ܵĿ���������Ҫ���ã�
�Ͻ�������Ͼ�����������������ܣ���������ܵĿ���������Ҫ���ã��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ca��HCO3��2��Һ���������NaOH��Һ��Ca2++HCO3-+OH-�TCaCO3��+H2O | |
| B�� | ��NH4HCO3��Һ�е�������NaOH��Һ��NH4++OH-�TNH3•H2O | |
| C�� | FeSO4��Һ�ڿ����б��ɫ��4Fe2++O2+4H+�T4Fe3++2H2O | |
| D�� | ��NaOH��Һ����NO2���壺3NO2+2NaOH�T2NaNO3+NO��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+��=10-13mol/L����Һ�У�NO3-��S2O32-��K+��Na+ | |
| B�� | ���Ը��������Һ�У�Na+��C2O42-��CH3COO -��NH4+ | |
| C�� | ����ʯ��ˮ�У�HCO3-��Ba2+��Cl-��NO3- | |
| D�� | ������SO2��NO��N2��NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
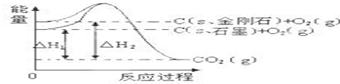
| A�� | 1molʯī���ܼ��ܱ�1mol���ʯ���ܼ���С1.9kJ | |
| B�� | ʯī�ͽ��ʯ��ת���������仯 | |
| C�� | ���ʯ���ȶ���ǿ��ʯī | |
| D�� | C��s��ʯī��=C��s�����ʯ����H=+1.9kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com