
【题目】明代宋应星 《天工开物·铜》写到:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的排布式为:________________________
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式________________________________________,[Cu(NH3)4]SO4·H2O中与Cu2+形成配位键的原子是________(填元素符号),若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行_________________实验。
(3)含有钡元素的盐的焰色反应为_______色,许多金属盐都可以发生焰色反应,其原因是______________________
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。
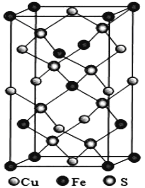
①Cu+的配位数为__________,
②已知:底边a=b=0.524 nm,高c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是___________gcm3(列出计算表达式即可)。
【答案】3d104s2 Cu(OH)2+4NH3H2O=Cu(NH3)2++2OH-+4H2O N X-射线衍射 黄绿色 电子由较高能级跃迁到较低能级时,以光的形式释放能量 4 ![]()
【解析】
本题主要考察原子的核外电子排布规律、配位化合物、焰色反应、晶胞的相关计算。
(1)该过渡元素位于第四周期,其基态原子的第三能层的能级全部排满,由于4s轨道的能量比3d轨道低,所以4s轨道一定排满了电子,则其外围电子排布式为3d104s2;
(2)蓝色絮状沉淀滴加过量氨水的离子反应方程式为Cu(OH)2+4NH3H2O=Cu(NH3)2++2OH-+4H2O;与Cu2+形成配位键的原子是N,若要确定某物质是晶体还是非晶体,最科学的方法是对其进行X-单晶衍射实验;
(3)含有钡元素的盐的焰色反应为黄绿色;焰色反应的原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)1个Cu+周围有2个Fe3+和两个S2-,故其配位数为4;该晶胞含有Cu+的个数为:![]() =4,Fe3+的个数为:
=4,Fe3+的个数为:![]() =4,S2-的个数为:8×1=8,则该晶胞的密度为:
=4,S2-的个数为:8×1=8,则该晶胞的密度为: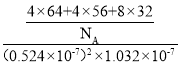 =
=![]() gcm-3。
gcm-3。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如图:
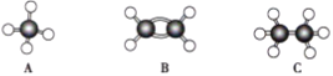
(1).等质量的以上物质完全燃烧时耗去O2的量最多的是______(填对应字母,下同)
(2).同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是______
(3).等质量的以上三种物质燃烧时,生成水最多的是______
(4).在120℃、1.01×105Pa条件下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
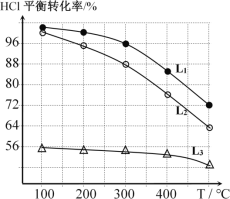
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
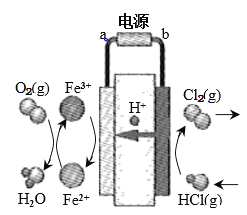
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.2 mol·L1Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是___________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.呗Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。

步骤二:_____________(按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
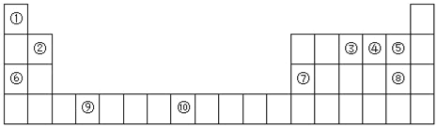
(1)表中属于s区的非金属元素是________(用元素符号表示),元素⑩核外电子排布式为________________,
(2)元素③④⑤电负性由小到大___________(用元素符号表示)
(3)若元素③用R表示,为什么可以形成RCl3分子,不可以形成RCl5分子:____________。
(4)元素⑤与⑧元素相比非金属性较强的是________(写元素名称),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性 B.两元素的电负性
C.单质分子中的键能 D.含氧酸的酸性
E.氢化物中X—H键的键长 F.两单质在自然界中的存在形式
(5)元素⑦的氧化物与元素⑧的最高价氧化物的水化物反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
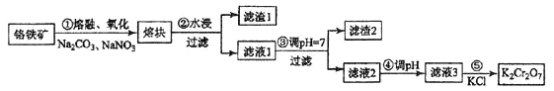
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置在实验室进行氨的催化氧化实验。

已知:NO2在高于150℃时不稳定,容易分解成NO和O2
(1)氨的催化氧化反应的化学方程式为___。
(2)广口瓶c中观察到红棕色气体,是因为___。
(3)实验发现,停止加热直玻璃管后,短时间直玻璃管内仍未观察到红棕色气体,说明直玻璃管中反应是___反应(填“吸热”或“放热”)。
(4)停止通O2,持续通NH3,广口瓶C中红棕色慢慢褪去,出现大量白烟,可能是生成了___。
(5)实验室检验NH3的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是

A.其能量转化的形式主要是“化学能→电能→光能”
B.如果将锌片换成铁片,电路中的电流方向将改变
C.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
D.如果将稀硫酸换成醋酸,LED灯将不会发光
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com