

���� ��1��������ѧ��ѧ������ʵ���������ƣ��μ�Ũ����ʱ�÷�Һ©����
��2���ݻ�ѧ��Ӧǰ��MnԪ�ؼ�̬�������ݡ���ʧ������ԭ�������û�ԭ����������������
��3����Cl2����������Ư���ԣ�����Cl2��H2O��Ӧ���ɵ�HClO����Ư������������
��4����������ǿ�����ԣ��ܹ��������������ɵ��ʵ⣬���������۱�����
��5�������ж�����ֱ���ŷŵ������У�
��6���ݷ���ʽ2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+8Cl2��+8H2O����
��7���پ����ʻ��ϼ۴�����Ϊ0������
�ھ�NaClO��һ��ǿ��������������
��� �⣺��1���μ�Ũ����ʱ�÷�Һ©�����ʴ�Ϊ����Һ©����
��2���ɷ���ʽ2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+8Cl2��+8H2O�÷�Ӧǰ��MnԪ�ؼ�̬���ͣ������ݡ���ʧ������ԭ�������û�ԭ��������������KMnO4����������
�ʴ�Ϊ����������
��3����Ϊ�����Cl2����������Ư���ԣ����ܽ���ɫ������ɫ����B���ﲼ������ɫ��C�в�����ˮ�����Cl2+H2O=HCl+HClO�����ɵ�HClO����Ư�����ܽ���ɫ������ɫ����C��ɫ��
�ʴ�Ϊ��C��������ˮ��Ӧ���ɵĴ��������Ư���ԣ�
��4����������ǿ�����ԣ��ܹ��������������ɵ��ʵ⣬��ѧ����ʽ��Cl2+2KI=2KCl+I2�����������۱��������Իῴ����Һ������
�ʴ�Ϊ����ɫ��Cl2+2KI=2KCl+I2��
��5�������������ж����壬����ֱ���ŷŵ������У�����ü�Һ���գ��ʴ�Ϊ��β��������
��6��n��KMnO4��=31.6��158=0.2mol
2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+8Cl2��+8H2O
2mol 8��22.4L
0.2mol 17.92L
�ʴ�Ϊ��17.92��
��7����OԪ�ػ��ϼ�Ϊ-2�ۣ��������л��ϼ۴�����Ϊ0��ClԪ�صĻ��ϼ�Ϊ+4�ۣ��ʴ�Ϊ��+4��
��NaClO��һ��ǿ��������˿�����ɱ��������NaClO�����־���Ư���ԣ��ʴ�Ϊ��ɱ����������Ư�ף�
���� ���⿼���������������ᣬ�������Ƶ�������ʣ������ۺ��Խϴ�����Ŀ�ѶȲ��Ǻܴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C7H16��������5��̼ԭ�ӵ�ͬ���칹����5�� | |
| B�� | ��ϵͳ���������������������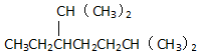 2��6-����-3-�һ����� 2��6-����-3-�һ����� | |
| C�� | ��Ȳ���ӵ����ģ�ͣ� | |
| D�� | ±�������������ữ����������Һ�������ɵ�±����������ɫ����±ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
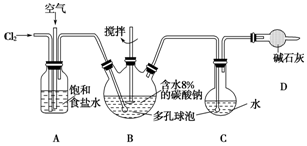
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
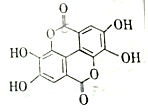 ����˫��һ�ֹ㷺�����ڸ��������������ֲ����֯�е���Ȼ��֣���ṹ��ʽ��ͼ������˫��ϡ����������ˮ�ⲻ�ܵõ��IJ��������ǣ�������
����˫��һ�ֹ㷺�����ڸ��������������ֲ����֯�е���Ȼ��֣���ṹ��ʽ��ͼ������˫��ϡ����������ˮ�ⲻ�ܵõ��IJ��������ǣ�������| A�� | �� | B�� | ȩ | C�� | �����廯���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ�� ��� | ��ʼ�¶�t1/�� | ��ֹ�¶� ��t2��/�� | �²� ��t2-t1��/�� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
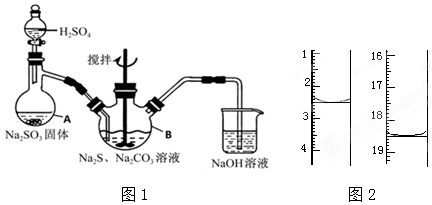
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 80mL10mol/L��Ũ����������MnO2��Ӧ��ת�Ƶ�����Ϊ0.4 NA | |
| B�� | ��״���£�22.4LNO��11.2L������ϣ�����ķ�������Ϊ1.5 NA | |
| C�� | 7.2 g CaO2�����������Ӻ�����������Ϊ0.3 NA | |
| D�� | ��1 mol NH4NO3����ϡ��ˮ��ʹ��Һ�����ԣ���Һ��NH4+��ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
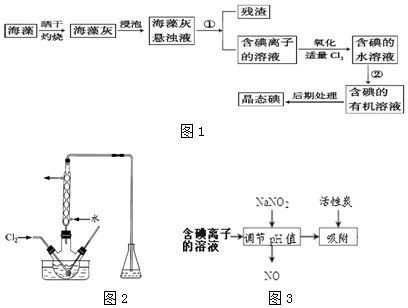
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com