
分析 普通玻璃坩埚、石英坩埚和陶瓷坩埚中都含有二氧化硅,二氧化硅与NaOH反应,而Fe与NaOH不反应.
解答 解:普通玻璃坩埚、石英坩埚和陶瓷坩埚中都含有二氧化硅,二氧化硅与NaOH反应,方程式为:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O,而Fe与NaOH不反应,所以可以用铁坩埚加热,
故答案为:普通玻璃坩埚、石英坩埚和陶瓷坩埚中都含有二氧化硅,二氧化硅与NaOH反应,而Fe与NaOH不反应.
点评 本题考查二氧化硅的性质,能与NaOH反应,难度不大,注意普通玻璃坩埚、石英坩埚和陶瓷坩埚中都含有二氧化硅是解题关键.


科目:高中化学 来源: 题型:解答题
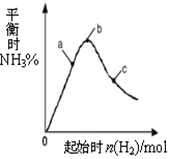 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
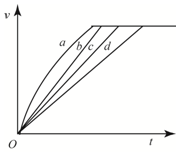 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第1组实验中盐酸的浓度大于2.5mol•L-1 | |
| B. | 第2组实验中盐酸的浓度大于2.5mol•L-1 | |
| C. | 第3组实验的反应温度低于30℃ | |
| D. | 第4组实验的反应速度最慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 氧化铁是金属氧化物 | 可做染料 |
| B | 氢氧化铝具有弱碱性 | 可用于制胃酸中和剂 |
| C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
| D | 硬铝是合金 | 其熔点比金属铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素仅存在于矿物中 | |
| B. | 金属元素存在于矿物和动物体內,但植物体內不含 | |
| C. | 少数金属元素以游离态存在,大多数金属元素以化合态存在 | |
| D. | 金属元素仅存在矿物中,动物和植物体內也不存在金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 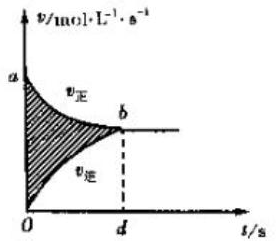 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 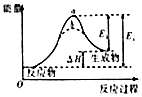 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 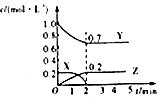 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 从蛇纹石组成看,其成皆是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
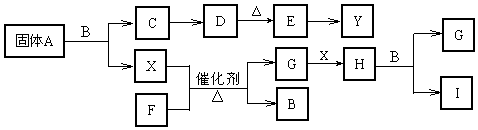
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com