
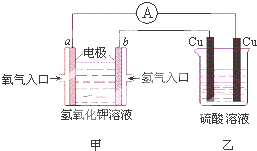
 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
| ||
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL0.5mol/L的明矾溶液与10mL0.5mol/LBa(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | ||||
| B、标况下22.4LCO2通入含1molCa(ClO)2的溶液中:ClO-+CO2+H2O=HCO3-+HClO | ||||
| C、1mol氢氧化铁沉淀中加入含3molHI的氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | ||||
D、用铜做电极电解氯化铜溶液:Cu2++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入NaOH溶液至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它为非金属 |
| B、其离子比Cu2+离子的氧化性强 |
| C、其低价氧化物是酸性氧化物 |
| D、它有+2价与+4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②④ | C、①③⑤ | D、② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com