
 ,
, ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、化学不再需要实验 |
| B、化学研究只需要计算机模拟就行了 |
| C、化学不再是纯实验科学 |
| D、未来化学的方向还是经验化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:
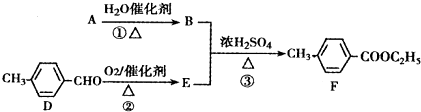
查看答案和解析>>
科目:高中化学 来源: 题型:
| D的单质 |
| D的单质 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
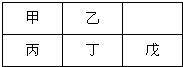 短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )
短周期金属元素甲-戊在元素周期表中的相对位置如图,下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、戊只与强碱反应 |
| C、最高价氧化物对应水化物碱性:乙>丁>戊 |
| D、金属性:丙>甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸是强电解质,醋酸是弱电解质 |
| B、电解质都能导电,非电解质都不能导电 |
| C、酸性氧化物都是非金属氧化物,碱性氧化物都是金属氧化物 |
| D、氢氧化铁胶体电泳时阴极附近颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与足量水反应并加热,收集到标准状况下V1L干燥气体 |
| B、与足量稀盐酸反应并蒸干,称量剩余固体质量m1g |
| C、隔绝空气加热,冷却后,称量剩余固体质量m2g |
| D、溶于足量水,滴入足量氯化钙溶液,过滤、洗涤、干燥、称重质量为m3g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com