
【题目】硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中![]() = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)![]() H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) ![]() COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)![]() H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
【答案】CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1 6bc466.7%0.42SO42--2e-=S2O82-
【解析】
由盖斯定律可得CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式;由Ka1×Ka2计算溶液中c(H+);在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态;恒容条件下,容器体积不变,混合气体质量不变,混合气体的密度不变;逆反应化学平衡常数为正反应化学平衡常数的倒数;依据题给条件建立三段式,运用化学平衡常数计算COS得消耗量;
(1)①由盖斯定律,a+b/2-c/2得CaO(S)+SO2(g)=CaSO3(S)ΔH=-402.0kJ/mol;②NaHSO3溶液中Ka1×Ka2=![]() ,由题给数据可得1.5×10-2×1.0×10-7
,由题给数据可得1.5×10-2×1.0×10-7
=1500×c2(H+),解得c(H+)=1.0×10-7mol/L,则pH为6。(2)①各物质的物质的量浓度保持不变是反应达到平衡的标志;恒温条件下,化学平衡常数为定值;形成H-S键代表正反应速率,形成H-H键代表逆反应速率,形成2molH-S键的同时形成1mol H-H键说明正、逆反应速率相等。②逆反应化学平衡常数为正反应化学平衡常数的倒数,正反应化学平衡常数K=0.25,则逆反应的化学平衡常数K1=1/K=4;达到平衡时COS的转化率为x,设由题给数据建立如下三段式:
COS(g) + H2(g) ![]() H2S(g) + CO(g)
H2S(g) + CO(g)
c(起) 0.1mol/L 0.1mol/L 0 0
c(变) 0.1xmol/L 0.1xmol/L 0.1xmol/L 0.1xmol/L
c(平) (0.1-0.1x) mol/L (0.1-0.1x) mol/L 0.1xmol/L 0.1xmol/L
由化学平衡常数可得:![]() =4,解得x=2/3。(3)①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,S2O82-中S元素化合价为+7价,设1mol S2O82-能氧化的Mn2+的物质的量为a,由得失电子数目守恒可得:1mol×2×(7-6)=a×(7-2),解得a=0.4 mol;电解硫酸和硫酸铵混合溶液的电解池中,阳极是SO42-失电子发生氧化反应的过程,电极反应式为:2SO42--2e-=S2O82-。
=4,解得x=2/3。(3)①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,S2O82-中S元素化合价为+7价,设1mol S2O82-能氧化的Mn2+的物质的量为a,由得失电子数目守恒可得:1mol×2×(7-6)=a×(7-2),解得a=0.4 mol;电解硫酸和硫酸铵混合溶液的电解池中,阳极是SO42-失电子发生氧化反应的过程,电极反应式为:2SO42--2e-=S2O82-。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 是原子序数依次增大的五种常
见元素,其中 A 是原子半径最小的元素,B 元素的一种核素可用于考古断代,D 元素的 s轨道和 p 轨道上的电子数相等且有2个未成对电子;E 是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。请用元素符号或化学式回答下列问题:
(1)A、B、C、D 四种元素中,电负性最大的是________,第一电离能最大的是________。
(2)化合物 CA3 的沸点比化合物 BA4 的高,其主要原因是___________________________ 。
(3)A、B 形成的化合物与氢氰酸(HCN)反应可得丙烯腈(H2CCHCN),丙烯腈分子中的碳原子轨道杂化类型是__________。
(4)由 C 元素形成的一种离子与 BD2 互为等电子体,该离子的结构式为__________。
(5)基态 E 原子的核外电子排布式为:_____________________________;D、E 形成的某种化合物的晶胞结构示意图如下,该晶体的化学式为__________。

(6)向 E 的硫酸盐溶液中通入过量的 CA3,可生成[E(CA3)4]2+,1 mol [E(CA3)4]2+中含有σ 键的数目约为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。

回答下列问题:
(1)![]() 的电子式为____________,
的电子式为____________,![]() 中含有的化学键是____________。
中含有的化学键是____________。
(2)下列关于雾霾的叙述错误的是______(填序号):
A.雾霾中含有硝酸铵和硫酸铵 B.![]() 是形成无机颗粒物的催化剂
是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关 D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入![]() 充分反应生成一种正盐,该反应的化学方程式为_________。
充分反应生成一种正盐,该反应的化学方程式为_________。
(4)在有氧条件下,催化剂能催化![]() 与
与![]() 反应生成
反应生成![]() 。将一定比例的
。将一定比例的![]() 、
、![]() 和
和![]() 混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,
混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380℃时,![]() 的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是____________。在无氧条件下,反应器中
的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是____________。在无氧条件下,反应器中![]() 能将
能将![]() 还原为
还原为![]() ,当生成
,当生成![]() 时转移电子______
时转移电子______![]() (可用分数表示)。
(可用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2+(蓝色)+H2O+V3+(绿色) ![]() VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
VO2+(黄色)+V2+(紫色)+2H+。下列说法错误的是
A. 充电时,反应每生成2 mol H+时转移的电子的物质的量为1 mol
B. 充电时,阳极附近溶液由绿色逐渐变为紫色
C. 放电时,负极反应为V2+-e-===V3+
D. 放电过程中,正极附近溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是

A. 曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系
B. Ka2(H2Y)=10-4.3
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )

A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2法不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。已知CH4和S的燃烧热(ΔH)分别为-890.3 kJ/mol和-297.2 kJ/mol,则CH4和SO2反应的热化学方程式为_________________。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为___________(填化学式),O~t1时间段的温度为_____________,0~t1时间段用SO2表示的化学反应速率为_________________。
②用H2还原SO2生成S的总反应的化学方程式为__________________。
(3)焦炭催化还原SO2生成S2,化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容密闭容器中,1 mol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容密闭容器中,1 mol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的ΔH_______(填“>”或“<”)0。
②计算a点的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是
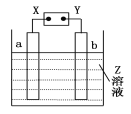
a极板 | b极板 | X电极 | Z | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 次氯酸的结构式:H-Cl-O
B. 氧根离子的电子式:![]()
C. 氯离子的结构示意图:
D. 中子数为146、质子数为92的铀(U)原子:14692U
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com