



科目:高中化学 来源: 题型:阅读理解
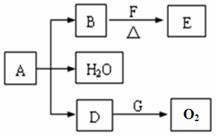
 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu CH3CHO+H2O+Cu
CH3CHO+H2O+Cu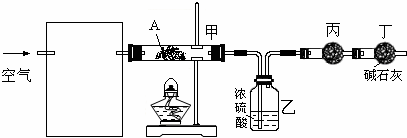
查看答案和解析>>
科目:高中化学 来源: 题型:
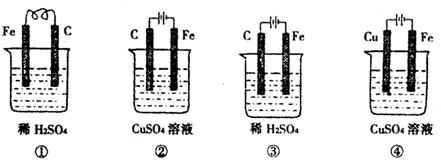
A.装置④是电镀池
B.四个装置中溶液的pH由小到大的顺序为③<②<①<④
C.②③中的阳极上均产生1.68 L(标准状况)气体
D.①③中Fe电极上的反应均为Fe-2e-====Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.(12分)【物质结构与性质】
1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
⑴科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 ▲ 。
⑵科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。

①写出基态Cu原子的核外电子排布式 ▲ ;金属铜采用下列 ▲ (填字母代号)堆积方式。
 |
A B C D
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来) ▲ 。
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响 ▲ 。
④SO42-的空间构型是 ▲ 。
B.(12分)【实验化学】
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热,过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀H2SO4中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
 回答下列问题:
回答下列问题:
⑴步骤三中称取的(NH4)2SO4质量为 ▲ 。
⑵①铁屑用Na2CO3溶液处理的目的是 ▲ 。制备FeSO4溶液时,用右图装置趁热过滤,原因是 ▲ 。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是 ▲ 。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀HCl溶液外,还应注意的问题是 ▲ 。
④该实验最终通过 ▲ 确定硫酸亚铁铵产品等级。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com