
| ||
| △ |
| ||
| △ |
| 2+1 |
| 2 |


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| 离子或物质 | 条件 | |
| A | SO2、O2、NO2 | 通入足量NaOH溶液后,可能没有任何气体剩余 |
| B | Fe3+、SO32-、Cl- | 加入NaOH溶液,产生红褐色沉淀 |
| C | Ba2+、HCO3-、Cl-、H+ | 加入氨水立即产生沉淀 |
| D | Na+、K+、Cl-、SO42- | c(Na+)+c(K+)=c(SO42-)+c(Cl-) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三处 | B、四处 | C、五处 | D、六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②④ | C、②④⑤ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
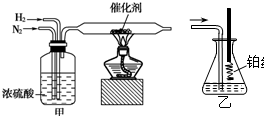
| 催化剂 |
| 高温高压 |
| A、使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B、工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C、上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D、温度升高,不利于氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应为吸热反应 |
| B、正反应为放热反应 |
| C、CO的浓度增大 |
| D、各物质的浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com