
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
分析 (1)根据v=$\frac{△c}{△t}$解题;
(2)以10至20min为例求出实验1和实验3的反应速率进行比较;
(3)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动.
解答 解:(1)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
故答案为:0.013;
(2)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
在实验3中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,实验1的其实浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,
故答案为:>;>;
(3)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法是解题的关键,题目难度中等.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe3O4、CuO | B. | C、CuO | C. | Fe、MnO2 | D. | Si、FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.
I.(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1 时引起平衡移动的条件可能是增大压强.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2):c(H2):c(NH3)=1:3:2 | |
| B. | 2v(H2)=3v(NH3) | |
| C. | 单位时间内1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 单位时间消耗0.1molN2的同时,生成0.2molNH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | HCl、BaCl2、AgNO3、Na2CO3 | B. | AgNO3、HCl、BaCl2、Na2CO3 | ||
| C. | BaCl2、Na2CO3、AgNO3、HCl | D. | AgNO3、HCl、Na2CO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
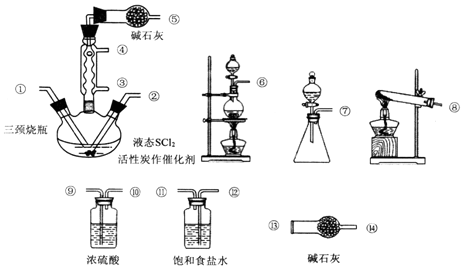
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
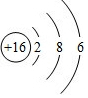 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com