
【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
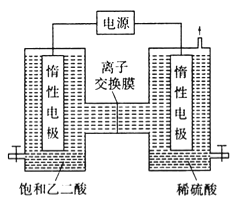
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。
【答案】 -308 > 不正确 温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小 50% 增大压强或及时分离出乙醛酸 阳 提供H+,作电解质溶液 HOOC-COOH + 2H+ + 2e- = OHC-COOH + H2O
【解析】I、(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,该反应的反应热为:2molC-H、1molO=0总键能与2molC-O、2molO-H总键能之差,△H=2mol×413kJmol-1+1mol×498kJmol-1-2mol×(351kJmol-1+465kJmol-1)=-308kJmol-1; (2)①曲线上的点代表一定温度下平衡时乙二醛的转化率,A点转化率高于B点,A点乙二醛转化得更多,由于此反应是一个放热反应,说明乙二醛转化得越多,放的热量就越多,则A点放出的热量多于B点放出的热量;②温度越高,催化效率越高,化学反应速率越快,而A点的温度低、催化效率高,B点的温度高、催化效率低,所以无法比较速率大小;③若投料比按照n(O2)/n(OHCCHO)=1/2,设O2为1mol、OHC-CHO为2mol,A点时乙二醛的转化率为60%,则转化的乙二醛为1.2mol,根据三行式:
2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)
2OHC-COOH(g)
起始(mol):2 1 0
变化(mol):1.2 0.6 1.2
平衡(mol):0.8 0.4 1.2
所以乙醛酸的体积分数为=乙醛酸的物质的量/气体总物质的量×100%=1.2mol/(0.8mol+0.4mol+1.2mol)×100%=50%;④为提高乙二醛的平衡转化率,应改变条件使平衡正向移动,除改变温度外,还可采取的措施是增大压强,或将产物分离出来,
故答案为:增大压强或及时分离出乙醛酸;Ⅱ、(1)由图可知,左边电极通入饱和乙二酸,生成乙醛酸,说明乙二酸发生还原反应,则左边为阴极,乙二酸获得电子,与通过质子交换膜的氢离子反应生成乙醛酸和水,说明离子交换膜是阳离子交换膜;(2)乙二酸与通过质子交换膜的氢离子反应生成乙醛酸和水,说明稀硫酸的作用是提供氢离子,作电解质溶液;(3)乙二酸得到电子,与通过质子交换膜的氢离子反应生成乙醛酸和水,电极反应式为:HOOC-COOH + 2H+ + 2e-=OHC-COOH + H2O。


科目:高中化学 来源: 题型:
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)

回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,世界上生产的镁有60%来自海水,其生产流程图如下

(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:__________________________________________。
(3)根据流程图可知 可循环利用的物质是______________________________。
(4)Mg与CO2反应时,有白色粉末并有黑色固体生成。请写出Mg与CO2反应的化学方程式并标出电子转移的方向与数目:____________________________________________________。
(5)Na比Mg和Al要活泼,将Na投入到 Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜(只允许阳离子通过)、阴离子交换膜(只允许阴离子通过)、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换技术原理,可电解Na2SO4溶液生产NaOH和H2SO4溶液。下列说法正确的是

A. 阳极反应式为2H++2e-===H2↑
B. 从D口出来的是NaOH溶液
C. 阴极区pH降低
D. 当电路中通过2mol电子的电量时,会有1mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚是一种重要的化工原料,以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N。(部分产物及反应条件已略去)
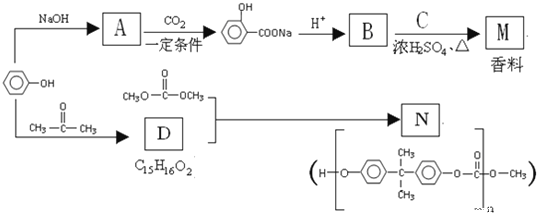
(1)有机物B的名称是_________。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种.C的结构简式是___________.
(3)B与C反应的反应类型是________由D生成N的反应类型是________。
(4)由苯酚生成D的化学方程式是_____________。
(5)F是分子量比B大14的同系物,则F的分子式是_________,F有多种同分异构体,符合下列条件的同分异构体有_____种。
①属于芳香族化合物;
②遇FeCl3溶液显紫色,且能发生水解反应;
③苯环上有两个取代基,且苯环上的一溴代物只有两种。
(6)已知: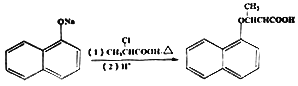 ,写出以苯酚、乙醇和CH2ClCOOH为原料制备
,写出以苯酚、乙醇和CH2ClCOOH为原料制备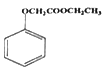 的合成路线流程图(无机试剂任用)。_____
的合成路线流程图(无机试剂任用)。_____
合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素。A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol·L-1D溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是( )

A. X、Y、Z元素的离子半径大小是X>Y>Z
B. X元素的氢化物沸点比同主族元素的氢化物低
C. Y与Q和W与Q元素形成的化合物化学键类型相同
D. Q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 40K与40Ca原子中的中子数相等
B. 互为同位素的两种原子,它们原子核内的质子数一定相等
C. 人们发现了112种元素,即共有112种原子
D. 原子结构模型演变历史可以表示为:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com