
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |


科目:高中化学 来源: 题型:
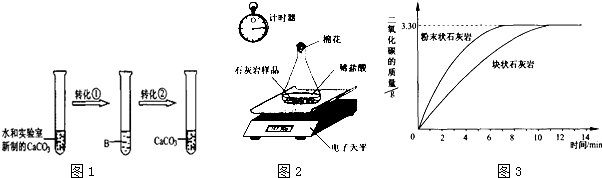
查看答案和解析>>
科目:高中化学 来源: 题型:
A、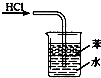 用于吸收HCl气体 |
B、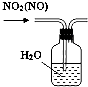 用于除去NO2中的NO |
C、 配制1mol/L NaCl溶液定容操作 |
D、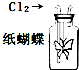 滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
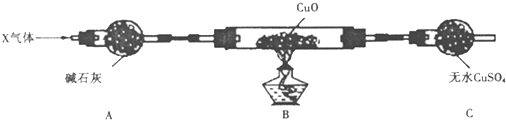
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| B、玻璃钢、航天飞机上的隔热陶瓷瓦都属于复合材料 |
| C、氧化钠可作为呼吸面具和潜水艇里氧气的来源 |
| D、铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解粗盐时,应尽量使溶液稀些,以保证食盐完全溶解 |
| B、滤去不溶性杂质以后,将滤液移至坩埚内加热浓缩 |
| C、当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、将制得的晶体转移到新制过滤器中用大量蒸馏水进行洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温恒压条件下混合气体相对密度不再改变可以说明该反应已经达平衡状态 |
| B、恒容通入氩气,使反应体系的压强增大,反应速率必定增大 |
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| D、随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小最后为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、.已知
| ||||||||||||||||||||||||||
| B、已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2 | ||||||||||||||||||||||||||
C、常温下
| ||||||||||||||||||||||||||
D、由下列短周期元素性质的数据推断元素⑤最高价氧化物对应的水化物酸性最强
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com