
【题目】Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制取氢气:BH4- + 2H2O == BO2- + 4H2↑(反应实质为水电离出来的H+被还原)。研究表明,该反应生成H2的速率受外界条件影响,下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间)。
体系 pH | 不同温度下的半衰期(min) | |||
0℃ | 25℃ | 50℃ | 75℃ | |
8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(1)已知NaBH4与水反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因 ,溶液中各离子浓度大小关系为 。
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响? 。
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响? 。
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃。肼和氧气在不同温度和催化剂条件下生成不同产物(如图)。

温度较低时主要反应①:N2H4 + O2 ![]() N2 + 2H2O
N2 + 2H2O
温度较高时主要反应②:N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
不考虑其他反应,完成下列填空:
(4)若反应①在250℃时的平衡常数为K1,350℃时的平衡常数为K2,则K1 K2(填“>”、“<”或“=”)。
(5)反应于1100℃时达到平衡后,下列措施能使容器中![]() 增大的有 (填字母序号)。
增大的有 (填字母序号)。
A.恒容条件下,充入He气
B.增大容器体积
C.恒容条件下,充入N2H4
D.使用催化剂
(6)若将n mol肼和2n molO2充入某容积为n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率x,NO的产率为y,则该条件下反应②的平衡常数K= (用x、y的代数式表示,不必化简)。
【答案】
(1)BO2- + 2H2O ![]() H3BO3 + OH- (2分)
H3BO3 + OH- (2分)
c(Na+)>c(BO2-)>c(OH-)>c(H+) (2分)
(2)温度越高,反应速率越大 (2分)
(3)体系碱性越强,水电离出来的H+浓度越低,因而反应速率越小 (2分,合理答案均给分)
(4)< (2分)
(5)BC (2分)
(6)![]() (3分)
(3分)
【解析】
试题分析:
Ⅰ.(1)NaBH4与水反应制氢气:BH4-+2H2O==BO2-+4H2↑,生成的BO2-水解使溶液显碱性,故溶液中离子浓度大小为c(Na+)>c(BO2-)>c(OH-)>c(H+)。
(2)从图表数据分析,相同pH条件下,随温度升高体系半衰期缩短,反应速率增大。
(3)NaBH4与水反应制氢气:BH4-+2H2O==BO2-+4H2↑,因为反应实质是水电离出来的H+被还原,所以随着pH增大,体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢;从表格中的数据也能看出,相同温度条件下,随着pH增大,半衰期延长,反应速率减慢。
Ⅱ.(4)从图像上看,温度低于400℃时,温度升高,N2产率增大,即平衡正向移动,平衡常数增大,所以K1<K2;
(5)B、C两项,增大容器体积和恒容条件下充入N2H4都使平衡正向移动,所以![]() 增大,A、D两项,恒容条件下充入氦气和使用催化剂,都不能使平衡发生移动,所以
增大,A、D两项,恒容条件下充入氦气和使用催化剂,都不能使平衡发生移动,所以![]() 不变;
不变;
(6)N2的理论产量为n mol,NO的理论产量2n mol,根据产率可算出平衡时n(N2)=nx mol、n(NO)=2ny mol,换算成浓度c(N2)=x mol·L-1、c(NO)=2y mol·L-1,用同样方法计算各物质的浓度如下:
N2H4 + O2 ![]() N2 + 2H2O N2H4 + 2O2
N2 + 2H2O N2H4 + 2O2 ![]() 2NO + 2H2O
2NO + 2H2O
起始浓度(mol·L-1) 1 2 0 0 1 2 0 0
转化浓度(mol·L-1) x x x 2x y 2y 2y 2y
平衡浓度: c(N2H4)=(1-x-y) mol·L-1 c(O2)=(2-x-2y) mol·L-1
c(NO)=2y mol·L-1 c(H2O)=(2x+2y) mol·L-1
故反应②的平衡常数![]() 。
。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】原电池由A、B、C、D四种金属按下表中装置图进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________。
(2)装置乙中正极的电极反应式是________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2化学与技术】将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌。已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO、PbO、CdO。制备工艺流程如下:
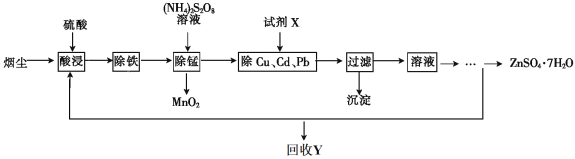
已知:相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.5 | 8.0 |
Fe2+ | 5.8 | 8.8 |
(1)回收的产品Y是_____________________。
(2)“除铁”时,先加入_________________(氧化剂、还原剂),再将溶液的pH调整到__________。
(3)“除锰”时溶液中发生反应的化学方程式为____________________。
(4)除去Cu、Cd、Pb的同时可以回收一些重金属,试剂X为__________________。
(5)ZnSO4溶液经过__________、__________、过滤及干燥得到ZnSO4·7H2O。
(6)为了测定产品中ZnSO4·7H2O的含量,取ag产品溶于水,向所得溶液中慢慢加入碳酸钠溶液至沉淀完全;过滤、洗涤沉淀,在将沉淀固体煅烧至完全分解,称得为bg,则产品中ZnSO4·7H2O的质量分数是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【实验化学】
己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]()

可能用到的有关数据如下:

实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)仪器a的名称为_ _。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果: _。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O
如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为(写一个即可):
________ ____。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中含有K2SO3、K2CO3、FeO、MnO2等物质,现取X进行连续实验,实验过程及产物如下:
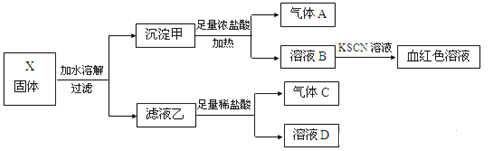
请回答:
(1)气体C的主要成分(填化学式)________。
(2)溶液B中存在的所有阳离子是___________________ 。
(3)沉淀甲中加浓盐酸产生气体A的离子方程式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,D原子核外电子有8种不同的运动状态, E是用途最广泛的金属,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)E元素在周期表中的位置 ;F+的电子排布式为 。
(2)化合物BD(CA2)2中,B原子的杂化方式为 ,1mol该分子中σ键数目为 个,该物质易溶于水的主要原因是 _ _____________。
(3)ACD3中阴离子CD3-的空间构型为 ,ACD3酸性比ACD2强,原因是___________。
(4)根据等电子体原理,BD分子的电子式为 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于 晶体。
(5)3g B2A6在足量氧气中燃烧并恢复到室温,放出Q kJ热量,则表示B2A6燃烧热的热化学方程式为
______ _ _____________。
(6)将F单质粉末加入到CA3的浓溶液中,并通入D2,充分反应后溶液呈深蓝色,写出该反应的化学方程式 _ _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为______ _________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:![]()
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是___ ____。由TiCl4→Ti需要在Ar气中进行的理由是___ _______。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
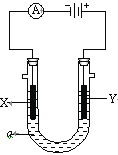
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R”18OH![]() RCO18OR”+R’OH(R、R’、R”代表烃基)
RCO18OR”+R’OH(R、R’、R”代表烃基)
![]()
![]() Ⅱ.
Ⅱ.  (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol 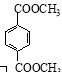 与足量NaOH溶液反应时,最多消耗4 mol NaOH[
与足量NaOH溶液反应时,最多消耗4 mol NaOH[
(7)写出由PET单体制备PET聚酯并生成B的化学方程式________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com