
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验一:碘含量的测定
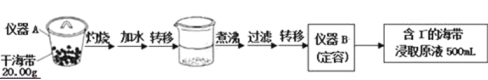
取0.0100mol/L的AgNO3标准溶液滴定100.00mL海带浸取原液,用电势滴定法测定碘的含量.测得的电动势(E)反映溶液中c(I﹣) 变化,用数字传感器绘制出滴定过程中曲线变化如图所示:

实验二:碘的制取
另取海带浸取原液,甲、乙两种实验方案如图所示:
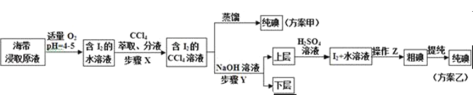
已知:3I2+6NaOH→5NaI+NaIO3+3H2O
请回答:
(1)实验一中的仪器名称:仪器A______,仪器B______;实验二中操作Z的名称______.
(2)根据表中曲线可知:此次滴定终点时用去AgNO3溶液的体积为______ml,计算该海带中碘的百分含量为______.
(3)步骤X中,萃取后分液漏斗内观察到的现象是______.
(4)下列有关步骤Y的说法,正确的是______
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
方案乙中,上层液体加硫酸发生反应的离子方程式是______.
(5)方案甲中采用蒸馏不合理,理由是______.
【答案】坩埚 500ml容量瓶 过滤 20.00 0.635% 液体分上下两层,下层呈紫红色 AB 5I﹣+IO3﹣+6H+=3I2+3H2O 碘单质易升华,会导致碘损失
【解析】
(1)在仪器A中灼烧海带,该仪器为坩埚;配制溶液体积为500mL,应该选用规格为500mL的容量瓶;碘单质不溶于水,可以通过过滤操作分离出碘单质;
(2)根据图象判断滴定终点时用去AgNO3溶液的体积;根据硝酸银与碘离子的反应计算出100mL溶液中含有碘离子的物质的量,再计算出500mL溶液中含有的碘离子,最后计算出海带中碘的百分含量;
(3)碘单质易溶于有机溶剂,且四氯化碳溶液密度大于水溶液,检查判断萃取现象;
(4)A.反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液;
B.碘单质与氢氧化钠反应生成了碘化钠、碘酸钠;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,便于后续分离出碘单质;
D.乙醇易溶于水和四氯化碳,仍然无法分离出碘单质;
在酸性条件下,I﹣和IO3﹣发生归中反应;
(5)从碘单质易升华角度分析。
(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成;
(2)根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×![]() =0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:
=0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:![]() ×100%=0.635%;
×100%=0.635%;
(3)碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色;
(4)A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
答案选AB;
在酸性条件下,I﹣和IO3﹣反应生成I2,发生反应的离子方程式为5I﹣+IO3﹣+6H+=3I2+3H2O;
(5)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系。下列说法错误的是
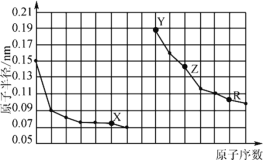
A.X、R的最高化合价相同
B.电解熔融的X与Z构成的化合物可以得到单质Z
C.X、Y形成的化合物中阳离子与阴离子的个数比一定是2:1
D.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是

A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B. Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器内,加入0.8 mol H2和0.6 mol I2,在一定条件下发生反应:H2(g)+I2(g)2HI(g)ΔH<0。反应中各物质的物质的量随时间变化情况如图:

(1)该反应的化学平衡常数表达式为______,若升高温度,化学平衡常数K______(填“增大”、“减小”或“不变”)。
(2)根据图中数据,反应开始至达到平衡时,平均速率v(HI)=_____mol·L-1·min-1,转化率α(H2)=_____。
(3)HI的体积分数φ(HI)随时间变化如图中曲线Ⅱ所示。若改变反应条件,在甲条件下φ(HI)的变化如图中曲线Ⅰ所示,在乙条件下φ(HI)的变化如图中曲线Ⅲ所示。则甲条件可能是_____(填入下列条件的序号,下同),乙条件可能是______。

①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的化学品M和N的合成路线如图所示:

已知:i.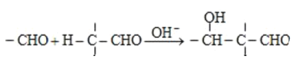
ii.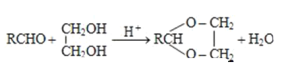
iiiN的结构简式是:
请回答下列问题:
(1)A中含氧官能团名称是______,C 与E生成M的反应类型是______.
(2)写出下列物质的结构简式:X:______ Z:______ E:______
(3)C和甲醇反应的产物可以发生聚合反应.该聚合反应的产物是:______.
(4)1mol G一定条件下,最多能与______mol H2发生反应
(5)写出一种符合下列要求G的同分异构体______
①有碳碳叄键 ②能发生银镜反应 ③一氯取代物只有2种
(6)1,3﹣丙二醇是重要的化工物质,请设计由乙醇合成它的流程图______,合成路线流程图示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有甲、乙、丙三瓶等体积的新制的氯水,浓度均为0.1molL-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量NaHSO3(mmol),丙瓶不变,片刻后甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙B.甲>乙>丙C.丙>甲=乙D.甲>丙>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol·L-1氯化铁溶液中阳离子数目大于NA
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( NaOH)相等
D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+2O2(g) = 4SO3 (g)的H相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2HI(g)![]() H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
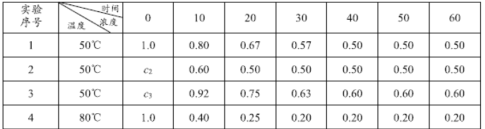
(1)实验1中,反应在010 min内平均速率v(HI)为_______mol·L-1·min-1。仔细分析上表数据可推知Q ______0 (填“>”“<”或“=”)。
(2)实验2中,HI的初始浓度c2 为_____mol·L-1.设平衡前实验1的平均反应速率为v1,平衡前实验3的平均反应速率为v3,则v1 ____v3 (填“>”“<”或“=”),且 c3为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com