
 硫及其化合物广泛存在于自然界中,回答下列问题:
硫及其化合物广泛存在于自然界中,回答下列问题:分析 (1)S原子核外电子数为16,根据能量最低原理书写核外电子排布式;同一能级中的电子优先占据一个轨道,且自旋方向相同;
(2)H2S分子中S原子形成2个σ键,含有2对孤对电子,为V形结构,分子中正负电荷重心不重合,属于极性分子;
(3)SO2分子中原子之间形成2对共用电子对,S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,则S原子杂化轨道数目为3;互为等电子体的微粒它们的空间构型相同,而原子总数相等、价电子总数相同的微粒互为等电子体;
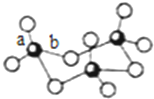
(4)黑色球为S原子,白色球为O原子,连接2个S原子的氧原子与S原子之间形成单键,连接1个S原子的氧原子与S之间形成双键,双键比较单键稳定,双键的键长较短.双键含有1个σ键、1个π键.
解答 解:(1)S原子核外电子数为16,核外电子排布式为:1s22s22p63s23p4,同一能级中的电子优先占据一个轨道,且自旋方向相同,在基态32S原子中,3p能级中有2个电子单独占据一个轨道,
故答案为:1s22s22p63s23p4;2;
(2)H2S分子中S原子形成2个σ键,含有2对孤对电子,为V形结构,分子中正负电荷重心不重合,属于极性分子,故答案为:V;极性;
(3)SO2分子中原子之间形成2对共用电子对,含有σ键、π键,S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,则S原子杂化轨道数目为3,S原子采取sp2杂化;互为等电子体的微粒它们的空间构型相同,与SO2具有相同空间构型的微粒为H2O、H2S等,
故答案为:σ键、π键;sp2;H2O、H2S等;
(4)黑色球为S原子,白色球为O原子,连接2个S原子的氧原子与S原子之间形成单键,连接1个S原子的氧原子与S之间形成双键,双键比较单键稳定,双键的键长较短,较短的键为a,双键含有1个σ键、1个π键,该分子中含有12个σ键,
故答案为:a;12.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、分子构型、杂化方式、化学键、等电子体、分子极性等,旨在考查学生对基础知识的理解掌握,难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:填空题
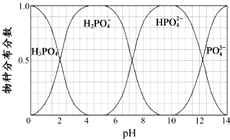 磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.
磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | 用pH试纸测溶液的pH时,需先用蒸馏水润湿试纸 | |
| C. | 0.2 mol/L的盐酸与等体积水混合后pH约为1 | |
| D. | 25℃时,pH=12的氨水溶液与pH=2的盐酸等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
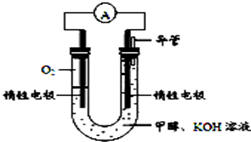 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 0.5NA个O2的质量为32g | |
| D. | 常温常压下,14g N2含有分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径依次增大 | B. | 单质的熔沸点逐渐升高 | ||
| C. | 卤离子的还原性逐渐减弱 | D. | 氢化物的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
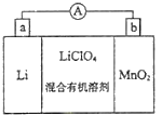 如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:
如图是锂锰电池的反应原理示意图,其中电解质KClO4溶于混合有机溶剂中,Li+ 通过电解质迁移入MnO2晶格中,得到LiMnO2.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com