

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | A1(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
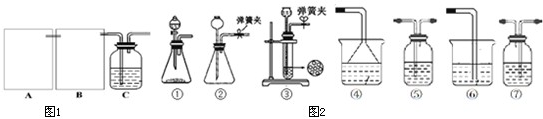
分析 Ⅰ、(1)工业上步骤①在反应过程中需不断搅拌是增大反应物的接触面积,增大反应速率;
(2)依据Cr2O72-+H2O?2CrO42-+2H+,用H2SO4调节溶液pH,使Na2CrO4转化为Na2Cr2O7,平衡逆向进行分析;
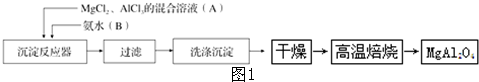
Ⅱ、过量废铁屑加入硫酸溶液中溶解,加入碳酸氢钠溶液搅拌过滤得到硫酸亚铁溶液和滤渣氢氧化铝,滤液中加入稀硫酸和亚硝酸钠氧化亚铁离子为铁离子,减压蒸发过滤得到碱式硫酸铁;
(3)Fe为活泼金属,可与酸反应;
(4)要制备硫酸亚铁,应与硫酸铝分离,根据沉淀的pH选择;
(5)所消耗氧气得到的电子的物质的量相当于NaNO2得到电子的物质的量;
(6)根据反应物和生成物判断离子方程式;
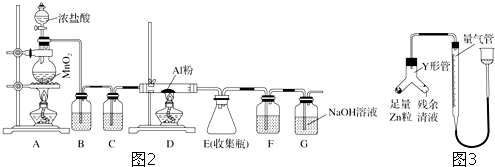
Ⅲ、阳极发生氧化反应,结合反应的方程式判断,电解池中电极商电子守恒,依据电子转移减少电解饱和氯化钠溶液中阴极电解反应中减小的氢离子物质的量,氢离子减小和溶液在亲一个离子增加物质的量相同,得到溶液中氢氧根离子浓度,结合离子积减少氢离子浓度得到溶液pH.
解答 解:I. (1)①4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高温\;}}{\;}$8Na2CrO4+2Fe2O3+8CO2,工业上步骤①在反应过程中需不断搅拌的目的是充分混合反应物增大接触面积,增大反应 速率,
故答案为:增大反应物的接触面积,加快反应速率;
(2)依据Cr2O72-+H2O?2CrO42-+2H+,用H2SO4调节溶液pH,使Na2CrO4转化为Na2Cr2O7,平衡逆向进行,反应的化学方程式为:2Na2CrO4+H2SO4═Na2C2O7+Na2SO4+H2O,
故答案为:2Na2CrO4+H2SO4═Na2C2O7+Na2SO4+H2O;
Ⅱ、(3)Fe为活泼金属,可与酸反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
(4)制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在[4.4~7.5)之间,故答案为:[4.4~7.5);
(5)n(O2)=$\frac{2.8L}{22.4L/mol}$=0.125mol,则得到电子0.125mol×4=0.5mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则m(NaNO2)=0.5mol×69g/mol=34.5g,故答案为:34.5;
(6)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;
Ⅲ、阳极发生氧化反应,由总反应式FePO4+Li $\frac{\underline{\;\;△\;\;}}{\;}$LiFePO4可知,LiFePO4被氧化生成FePO4,反应的电极方程式为LiFePO4-e-═FePO4+Li+,常温下以该电池为电源电解500mL饱和食盐水,当消耗0.35gLi时,n(Li)=$\frac{0.35g}{7g/mol}$=0.05mol,反应中电子转移0.05mol,电解食盐水,阴极电极反应为2H++2e-=H2↑,溶液中氢离子减小0.05mol,溶液中增加氢氧根离子物质的量为0..05mol,c(OH-)=$\frac{0.05mol}{0.5L}$=0.1mol/L,c(H+)=$\frac{1{0}^{-14}}{0.1}$=10-13mol/L,溶液的pH值为13,
故答案为:LiFePO4-e-═FePO4+Li+;13.
点评 本题考查制备原理的设计,题目难度中等,注意根据物质的性质和题给信息判断可能发生的反应,方程式的书写为解答该题的难点,也是易错点,注意体会书写方法,掌握基础是关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 将②、③混合,若pH=7,则消耗溶液的体积②=③ | |
| C. | 将四份溶液稀释相同的倍数后,溶液的pH:③>④>②>① | |
| D. | 将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液一定呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol O2和 0.3mol H2O | |
| B. | 0.1mol H2SO4和3.6g H2O | |
| C. | 0.1mol MgSO4•7H2O和0.1mol C12H22O11(蔗糖) | |
| D. | 6.02×1023个CO2与0.1mol KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O | |
| B. | 向水中通氯气:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 在强碱溶液中,次氯酸钠与Fe(OH)3 反应生成Na2FeO4,离子方程式:3ClO-+2Fe(OH)3═2FeO42-+H2O+3Cl-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com