
��14�֣�
��֪CO(g)+H2O(g) CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 ��H��+8.0kJ��mol��1
��H��+8.0kJ��mol��1 ��H��+90.4kJ��mol��1
��H��+90.4kJ��mol��1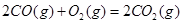 ��H��-556.0kJ��mol��1
��H��-556.0kJ��mol��1 ��H��-483.6kJ��mol��1
��H��-483.6kJ��mol��1 ��
�� ��Ӧ����
��Ӧ���� �Ȼ�ѧ����ʽ ��
�Ȼ�ѧ����ʽ �� ��ÿ��2�֣�
��1�� < ��2�֣� ��2��0.018 mol��L-1 80% ����2�֣� ��3��c d��2�֣�
��4��14.4��2�֣�
��5��������O2 + 4e- + 2CO2 = 2CO32-��2�֣�
��6��S��g��+O2��g��= SO2��g�� ��H=-574.0kJmol-1��2�֣�
���������������1���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ������H��0��
��2����Ӧ��ʼ6s��A��ƽ����Ӧ����v��CO��=0.003mol?L-1?s-1����6s��c��CO2��=��c��CO��=0.003mol?L-1?s-1��6s=0.018mol?L?1��CO����ʼŨ��=0.2mol/5L=0.04mol?L?1��
��ƽ��ʱA��Ũ�ȱ仯��Ϊx����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����0.04 0.16 0 0
�仯��mol/L����x x x x
ƽ�⣨mol/L����0.04-x 0.16-x x x
��x?x/(0.04?x)(0.16?x) =1�����x=0.032mol/L������ƽ��ʱA��ת����=0.032mol/L ��0.04mol?L?1��100%=80%
��3��a���÷�Ӧǰ����������ʵ������䣬ѹǿʼ�ղ��䣬��ѹǿ����ʱ��ı䣬����˵������ƽ�⣬����b�������������������䣬�������ݻ����䣬�ʻ��������ܶ�ʼ�ղ��䣬��������ܶȲ���ʱ��ı䣬����˵������ƽ�⣬����c�����淴Ӧ����ƽ��ʱ������ֵ�Ũ�Ȳ������仯����c��CO������ʱ��ı䣬˵������ƽ�⣬��ȷ��d����λʱ��������CO��H2�����ʵ�����ȣ�����Ӧ���ʵ����淴Ӧ���ʣ�˵������ƽ�⣬��ȷ��
��4����CO��H2O����ʼŨ�ȷֱ�Ϊx��y����CO��ת����Ϊ90%����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼŨ�ȣ�mol?L-1�� x y������ 0������0
ת��Ũ�ȣ�mol?L-1�� 0.9x ��0.9x 0.9x�� 0.9x
ƽ��Ũ�ȣ�mol?L-1�� 0.1x�� y-0.9x�� 0.9x�� 0.9x
K=0.9x?0.9x ��[0.1x?(y?0.9x)] =0.6����y/x=14.4��ֻҪ����H2O�����Ϳ����CO��ת���ʡ�
��5���õ���У�������Ӧһ���������õ��ӵĹ��̣��õ�صĵ���ʻ���������̼���Σ����Ե缫��ӦΪ��O2+2CO2+4e-=2CO32- ����2O2+4CO2+8e-=4CO32-��
��6�����ݸ�˹���ɣ�S��g��+O2��g��=SO2��g��������֪��Ӧ����+��-��-�ڣ�/2�õ�����S��g����O2��g����Ӧ����SO2��g���Ȼ�ѧ����ʽΪ��S��g��+O2��g��=SO2��g����H=-574.0kJmol-1��
���㣺���⿼�黯ѧƽ���жϼ��ƶ���������ѧ��Ӧ���ʡ�ԭ���ԭ�����Ȼ�ѧ����ʽ��д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��5�֣�H2���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ģ�
��1����֪����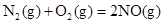
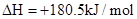
��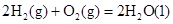
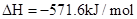
��H2��g����NO��g����Ӧ����N2��g����H2O��l�����Ȼ�ѧ����ʽΪ��________________��
��2��һ�������£������Ϊ2 L��������ͨ��1 mol H2��l mol NO��������N2��g����H2O��l�����÷�Ӧ��ƽ��ʱ�������ڵ�ѹǿ�Ƿ�Ӧ��ʼʱ��40�������������������䣬ֻ����������ͨ��1 mol H2�����㷴Ӧ�ٴ���ƽ��ʱ����ѧƽ�ⳣ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(6��)��3 mol A��3 mol B�����2 L���ܱ������У��������·�Ӧ��
3A(g)+B(g)  xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
��1��B��ƽ����Ӧ����Ϊ ��
��2��x��ֵΪ ��
��3��5 min��A��B�����ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ú̿ȼ�չ����л��ͷų�������SO2�������ƻ���̬����������һ����������������Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷš�����ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ����������Ч�ʡ���ط�Ӧ���Ȼ�ѧ����ʽ���£�
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��)
CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ��H2= -175.6kJ��mol��1(��Ӧ��)
CaS(s) + 4CO2(g) ��H2= -175.6kJ��mol��1(��Ӧ��)
��ش��������⣺
��1����Ӧ�����Է����е������� ��
��2�������������ķ�Ӧ����ʾƽ�ⳣ��Kpʱ���������(B)��ƽ��ѹǿp(B)������������ʵ���Ũ��c(B)����Ӧ���Kp= (�ñ���ʽ��ʾ)��
��3������ij�¶��£���Ӧ�������(v1)���ڷ�Ӧ�������(v2)�������з�Ӧ���������仯ʾ��ͼ��ȷ���� ��
��4��ͨ����ⷴӦ��ϵ������Ũ�ȵı仯�жϷ�Ӧ��͢��Ƿ�ͬʱ������������ ��
��5��ͼ1Ϊʵ���ò�ͬ�¶��·�Ӧ��ϵ��CO��ʼ����ٷ�����ƽ��ʱ���������CaS�����ٷ����Ĺ�ϵ���ߡ��÷�Ӧ��ϵ��SO2�������Ĵ�ʩ�� ��
A����÷�Ӧ��ϵ��Ͷ��ʯ��ʯ
B���ں��ʵ��¶������ڿ��ƽϵ͵ķ�Ӧ�¶�
C�����CO�ij�ʼ����ٷ���
D����߷�Ӧ��ϵ���¶�
��6�����º��������£����跴Ӧ��͢�ͬʱ��������v1��v2������ͼ2�л�����Ӧ��ϵ��c(SO2)��ʱ��t�仯��������ͼ��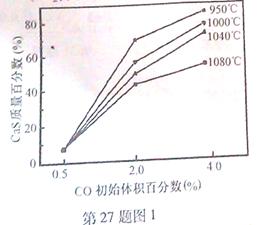
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��18�֣����û�ѧ��Ӧԭ���о������ȵȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
��1����ѧ���о���һ��������ͨ�����з�Ӧ�Ʊ�NH3: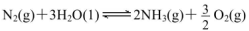
��������������ͬʱ����Ӧ��NH3���������(a)�ڲ�ͬ�¶����淴Ӧʱ��(t)�ı仯��ͼ���÷�Ӧ��ƽ�ⳣ������ʽK=______���÷�Ӧ�е�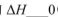 ���>����<����=������
���>����<����=������
��ij�¶��£���2L�ݻ�������ܱ������м���1molN2��6molH2O��1��������Ӧ��N2ת������ʱ��(t)�仯��ͼ��15-20min�ڣ�v(NH3)=____���������������䣬��ͼ�л���ʹ�ô�����N2��ת�����淴Ӧʱ��仯������ʾ��ͼ��
��2�� 25��ʱ��ijͬѧ��0.lmol ������0.2 mol
������0.2 mol ��ˮ�������ϣ����û����ҺpH______7���>����<����=������ͬ���������Һ��
��ˮ�������ϣ����û����ҺpH______7���>����<����=������ͬ���������Һ�� ��25��ʱ��NH3.H2O�ĵ��볣��
��25��ʱ��NH3.H2O�ĵ��볣��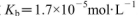 ��
��
��3�� 25��ʱ����O.lmol ��MgCl2��Һ����μ�������0.lmol
��MgCl2��Һ����μ�������0.lmol ��ˮ���а�ɫ�������ɣ���Ӧ�����Һ�У���������O.lmol
��ˮ���а�ɫ�������ɣ���Ӧ�����Һ�У���������O.lmol ��FeCl3��Һ���۲쵽��������______ �����������з��������з�Ӧ�����ӷ���ʽΪ______��(25��ʱ��
��FeCl3��Һ���۲쵽��������______ �����������з��������з�Ӧ�����ӷ���ʽΪ______��(25��ʱ��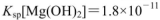 ��
��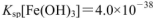 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(14��)��ҵ�����ұ�Ϊԭ����������ϩ�ķ�Ӧ���£�Ph������������
Ph��CH2CH3(g) Ph��CH��CH2(g)+H2(g) ��H
Ph��CH��CH2(g)+H2(g) ��H
ij�о�С��Ϊ̽���¶ȵ����ضԸ÷�Ӧ�IJ���Ӱ�죬���ݻ��ɱ���ܱ������зֱ���������ʵ�飬ʵ��������ͼa��b��ʾ��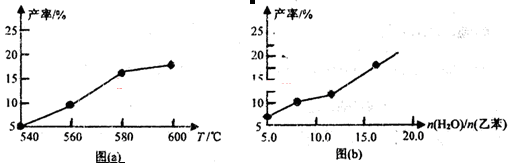
(1)���ݷ�Ӧ����ͼ(a)���жϡ�H 0(�������������������ͬ)����S 0����ѡ�á������˵ķ�Ӧ�¶ȣ� ��
(2)������ʵ����˵���÷�Ӧ�Ѵ�ƽ����� ��
A�����������ܶȲ��ٱ仯
B������������������ֲ���
C������������ϩ����������֮�ȱ��ֲ���
D����λʱ�������ĵ�n(�ұ�)�������ɵ�n(H2)
(3)��ѹǿ���ط�����Ϊ����ұ���ת���ʣ�Ӧ���� ������������ʵ�ʹ�ҵ�����г�����ͨ��ˮ�����ķ�����ˮ�����ĺ����Է�Ӧ��Ӱ��������ͼ(b)��ʾ��
������������ʵ��ʱ��Ӧ�ò��õ�����ʵ�������� ��
A����Ӧ�¶���ͬ B�����ò�ͬ�Ĵ���
C��ѹǿ�������ڳ�ѹ�� D����Ӧ��ͬʱ��ʱ�ⶨʵ������
��ͼ(b)������ ��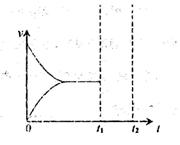
��һ���¶��£��ں�ѹ�ܱ������У�ͨ��һ����n(H2O)/n(�ұ�)��7��1�����壬����������Ӧ����t1ʱ�̴ﵽƽ�⡣���������������䣬��ʱ�����һ������ˮ��������t2ʱ�����´ﵽƽ�⣬������ͼ�л��練Ӧ�ٴδﵽƽ����̵�ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��15�֣�̼���仯�����й㷺����;��
��1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼���� ����
��2����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ?mol-1����Ҫ�Ʊ���״����22.4��ˮú����ת�Ƶĵ��ӵ����ʵ���Ϊ ����Ҫ���յ�����Ϊ kJ��
(3����ҵ�ϰ�ˮú���еĻ�����徭��������õĽϴ�H2���ںϳɰ���
N2��g����3H2��g�� 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��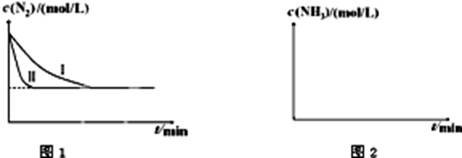
����ʵ���Ƚϣ�ʵ���ı������Ϊ�� ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��4��Na2CO3���ڽ������������ŷ�������CO2�IJ�����1L0.2mol/L Na2CO3��Һ���ձ�״����2.24LCO2����Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣�̼���仯��������������������������ء���ش��������⣺
��1���ڻ������������У�����CO�Ĵ��ڻ���������ж���Ϊ�˷�ֹ�����ж�������SO2��CO����SO2����ԭΪS��
��֪�� C(s)+ ��g��=CO��g����H1=-126��4kJ/mol ��
��g��=CO��g����H1=-126��4kJ/mol ��
C(s)+O2��g��=CO2��g�� ��H2= ��393��5kJ��mol��1 ��
S(s)+O2��g��=SO2��g�� ��H3= ��296��8kJ��mol��1 ��
��SO2����CO���Ȼ�ѧ��Ӧ����ʽ��
��2��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g) CH3OH(g)��
CH3OH(g)��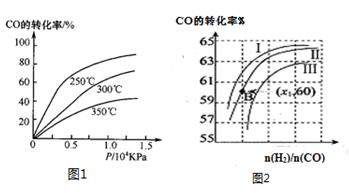
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��ʾ���÷�Ӧ��H 0���>���� <������
ͼ2��ʾCO��ת��������ʼͶ�ϱ�[ n(H2)/n(CO)]���¶ȵı仯��ϵ������I��II��III��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�Ĵ�С��ϵΪ �����B(X1,60)��������ת����Ϊ40%����x1= ��
���ں����ܱ������ﰴ�����Ϊ1:2����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ����� ������ţ���
| A������Ӧ������������С | B���淴Ӧ������������С |
| C����ѧƽ�ⳣ��Kֵ���� | D����Ӧ�������ٷֺ������� |
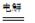 CH3CHOH+CH3CHOOH��
CH3CHOH+CH3CHOOH��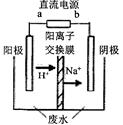
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣��ԭ��Ϊ��
N2(g)��3H2(g)  2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺
2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺
(1)�ٸ÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK�� ��
�ڸ����¶ȶԻ�ѧƽ���Ӱ����ɿ�֪�����ڸ÷�Ӧ���¶�Խ�ߣ���ƽ�ⳣ����ֵԽ ��
(2)ij�¶��£�����10 mol N2��30 mol H2�������Ϊ10 L���ܱ������ڣ���Ӧ�ﵽƽ��״̬ʱ����û�������а����������Ϊ20%������¶��·�Ӧ��K�� (���÷�����ʾ)����˵���÷�Ӧ�ﵽ��ѧƽ��״̬���� (����ĸ)��
a�������ڵ��ܶȱ��ֲ���
b��������ѹǿ���ֲ���
c��v��(N2)��2v��(NH3)
d�����������c(NH3)����
(3)���ںϳɰ���Ӧ���ԣ������й�ͼ��һ����ȷ����(ѡ�����) ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com