
| A. | 乙烯合成聚乙烯 | |
| B. | 烯烃与水煤气发生羰基合成反应RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO | |
| C. | 甲烷、CO合成乙酸乙酯2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3 | |
| D. | 实验室用乙醇制乙烯 |
分析 根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%,即生成物质只有一种.
解答 解:反应物全部转化为最终产物,生成物只有一种.即原子利用率为100%,
A、乙烯合成聚乙烯,产物只有一种,即原子的利用率为100%,符合“绿色化学”的思想,故A符合;
B、RCH=CH2+H2+CO$\stackrel{催化剂}{→}$RCH2CH2CHO,此反应中三种物质生成一种,符合“绿色化学”的思想,故B符合;
C、2CH4+2CO$\stackrel{催化剂}{→}$CH3COOCH2CH3,产物只有一种,故符合“绿色化学”的思想,故C符合;
D、实验室利用乙醇制取乙烯,乙醇发生消去反应生成乙烯和水,有两种产物,不符合“绿色化学”的思想,故D不符合;
故选D.
点评 本题考查绿色化学,难度不大.要抓住绿色化学的特征:原子利用率为100%,产物只有一种.


科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中滴加NaOH至溶液呈中性:c(Na+)═2c(ClO-)+c(HClO) | |
| B. | 100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 | |
| C. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)≥c(H+) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--CO2 | B. | 光化学污染--NO2 | C. | 酸雨--SO2 | D. | 臭氧层破坏--CO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
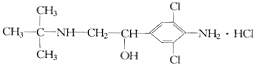
| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N20 | D. | 消去产物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com