
| A. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| B. | 漂白粉中的CaCl2与空气中的CO2反应可生成CaCO3,漂白粉在空气中久置变质 | |
| C. | NH3能使酚酞溶液变红,因而NH3可用于设计喷泉实验 | |
| D. | 打磨磁石制指南针不涉及化学反应 |
分析 A.漂白粉在空气中与水、二氧化碳反应生成不稳定的次氯酸,用于漂白纸张为漂白性;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳水反应生成次氯酸和碳酸钙;
C.氨水溶液呈碱性,可使酚酞变红,为化学性质,形成喷泉,为物理性质;
D.打磨磁石制指南针,只是改变物质的外形,没有新物质生成.
解答 解:A.漂白粉在空气中与水、二氧化碳反应生成不稳定的次氯酸,用于漂白纸张为漂白性,表现性质不同,故A错误;
B.漂白粉中有效成分次氯酸钙和空气中二氧化碳水反应生成次氯酸和碳酸钙,次氯酸见光分解,漂白粉失效,故B错误;
C.氨气可用于设计喷泉实验是因为氨气极易溶于水,并非氨气能使酚酞变红,故C错误;
D.打磨磁石制指南针,只是改变物质的外形,没有新物质生成,不涉及化学反应,故D正确.
故选D.
点评 本题考查物质性质、物质的检验和鉴别,为高频考点,把握物质的性质及现象分析判断为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 温度 | 0min | 10min | 20min | 30min | 40min | 50min | 60min |
| 1 | 820℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 820℃ | c1 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 800℃ | 1.0 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中加入少量铁粉即能观察到红色固体析出 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 | |
| C. | 该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 | |
| D. | 向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCl、H2SO4、NH3•H2O | B. | NaOH、HCl、H2SO4 | ||
| C. | HCl、H2SO4、NaOH | D. | HCl、NaOH、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
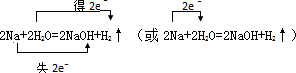 .反应中若产生0.2mol的气体,则有0.4mol的电子转移.
.反应中若产生0.2mol的气体,则有0.4mol的电子转移.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com