
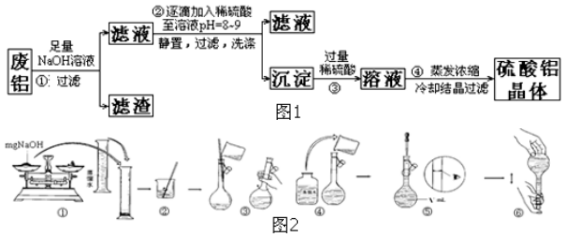
分析 由含铁废铝制备硫酸铝晶体原理是用氢氧化钠溶液溶解铝,过滤除掉杂质铁,然后调节PH得到氢氧化铝沉淀,氢氧化铝和稀硫酸溶液反应生成硫酸铝,蒸发浓缩、冷却、结晶、过滤、干燥后得到硫酸铝固体.
(1)过滤实验用到的玻璃仪器有:烧杯、漏斗、玻璃棒;
(2)用氯化钡检验硫酸根的存在,现象是出现白色沉淀;
(3)所得沉淀为氢氧化铝,加热分解分别生成氧化铝和水;
(4)氢氧化钠易潮解,不能在空气中称量;定容时要用胶头滴管;定容时视线要和刻度线相平.
解答 解:(1)过滤实验用到的玻璃仪器有:烧杯、漏斗、玻璃棒,
故答案为:烧杯、漏斗、玻璃棒;
(2)洗涤沉淀不干净时,在沉淀表面会附着硫酸钠,硫酸根的检验方法:取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净,
故答案为:取最后一次洗涤液,加入几滴BaCl2溶液,若无白色沉淀生成则洗涤干净;
(3)所得沉淀为氢氧化铝,加热分解分别生成氧化铝和水,方程式为Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+H2O,其中氧化铝为两性氧化物,水为非金属氧化物,
故答案为:Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+H2O;两性氧化物; 非金属氧化物;
(4)①氢氧化钠易潮解,应在小烧杯中称量,故①错误;④在移液时,要用玻璃棒来引流,故④错误;⑤定容时视线要和刻度线相平,不能俯视和仰视,故⑤错误,第⑤部操作可能会使溶液体积偏大,所配溶液浓度偏小,
故答案为:①④⑤;小.
点评 本题以实验题的形式来考查金属元素的单质及其化合物的性质,为高考常见题型,侧重考查学生的分析、实验能力,注意铝能与强碱性溶液反应是其他一般金属不具有的化学性质,掌握化学反应原理才能分析出实验步骤的目的,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:多选题
| A. | KOH是氧化剂 | B. | Cl2发生还原反应 | ||
| C. | KFeO4是氧化产物 | D. | 生成lmol K2Fe04转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都能与金属钠反应 | |
| B. | 乙醇、乙酸都能与NaOH溶液反应 | |
| C. | 乙醇、乙酸都能使紫色石蕊试液变红色 | |
| D. | 乙醇、乙酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | D. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| KI溶液(I2) | MnO2固体 (Fe) | 氯气(氯化氢) | NaCl溶液 (NaBr) | KI固体 (I2) | |
| 加入试剂 | 此处不填 | ||||
| 分离方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol Al与足量盐酸反应转移电子数为NA | |
| B. | 标准状况下,22.4 L氨气与22.4 L氮气所含原子数均为2 NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com