
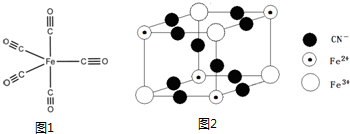
分析 (1)铁是26号元素,其原子核外有26个电子,铁原子失去2个电子变成Fe2+,根据构造原理书写Fe2+核外电子排布式;
(2)原子个数相等且价电子数相等的分子或离子为等电子体;
(3)乙酸中能形成分子间氢键;
(4)每个碳周围都有2个σ,或都是直线型,所以碳原子的轨道杂化类型是sp杂化,1mol Fe (CO)5分子中含有σ键的数目为10 NA;
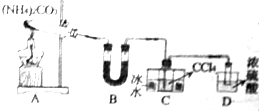
(5)应均摊法计算Fe2+、Fe3+和CN-的个数比.
解答 解:(1)铁是26号元素,其原子核外有26个电子,铁原子失去最外层2个电子变成Fe2+,根据构造原理知,其基态离子核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 ,故答案为:1s22s22p63s23p63d6 或[Ar]3d6 ;
(2)CO含有2个原子,且其价电子数是10,而CN-或过氧根中含有2个原子,且其价电子数是10,与CN-或过氧根等,故答案为:CN-或O22-;
(3)乙酸中能形成分子间氢键导致乙酸熔沸点比尿素高,故答案为:乙酸中能形成分子间氢键;
(4)每个碳周围都有2个σ,或都是直线型,所以碳原子的轨道杂化类型是sp杂化,1mol Fe (CO)5分子中含有σ键的数目为10 NA,故答案为:sp杂化;10 NA;
(5)Fe2+、Fe3+和CN-的个数比为4×$\frac{1}{8}$:4×$\frac{1}{8}$:10×$\frac{1}{4}$=1:1:5,故答案为:1:1:5.
点评 本题是一道结构化学模块知识题目,综合性较强,涉及等电子体、核外电子排布、氢键等知识,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 放热反应的发生无需任何条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N4是N2的同素异形体 | |
| B. | 等质量的N4和N2,N4体积是N2体积的一半 | |
| C. | 相同质量的N4和N2所含原子个数比为1:2 | |
| D. | N4的摩尔质量是56g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Na2CO3固体中少量NaHCO3:加热 | |
| B. | 除去CO2中少量SO2:通过饱和NaHCO3溶液 | |
| C. | 除去氯气中少量氯化氢:通过氢氧化钠溶液 | |
| D. | 除去氧化铁中少量氧化铝:加入过量的烧碱溶液后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸(
乳酸(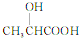 )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.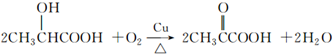 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
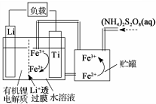
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O32-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的正极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe2+=Li+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学键存在于原子之间,也能存在于分子与离子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的吸引力 | |
| D. | 化学键通常指的是任意两个或多个原子之间强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | B. | 锌为负极,Ag2O为正极 | ||
| C. | 原电池工作时,Ag2O发生氧化反应 | D. | 原电池工作时,负极区溶液PH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com