
(10分)甲、乙、丙均为中学化学常见的气体单质,A、B、C为常见的化合物,A和B都极易溶于水,用玻璃棒分别蘸取A和B的浓溶液后,相互靠近会看到白烟。各物质之间存在如下图所示的转化关系:

请回答下列问题:
(1)丙与A反应生成乙和C的化学反应方程式为——————
(2)向0.1 mol/L的C溶液中通入A至显中性,溶液中各离子浓度由大到小的顺序为:__________.
(3)常温下取M的饱和溶液与AgI的饱和溶液等体积混合,再加入足量的AgNO3浓溶液发生反应,则生成沉淀的物质的量较多的是________。(填化学式)
(4)电解尿素[CO(NH2)2]的碱性溶液制取甲的装置示意图如右图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。

电解时,b极的电极反应是_______。若在a极产生112mL气体(标准状况),则消耗尿素的质量为______g。
(1)3Cl2+8NH3=6NH4Cl+N2;(2)c(NH4+)=c(Cl-)>c(OH-)=c(H+);(3)AgCl;
(4)CO(NH2)2+8OH--6e=CO32-+N2↑+6H2O;0.1
【解析】
试题分析:根据题意及物质之间的相互转化关系可知:甲是H2;乙是N2;丙是Cl2,A是NH3;B是HCl;C是NH4Cl;M是AgCl。(1)由于氧化性:Cl2>N2,所以丙与A反应生成乙和C的化学反应方程式为3Cl2+8NH3=6NH4Cl+N2;(2) NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解反应消耗水电离产生的OH-,最终溶液显酸性。向0.1 mol/L的C溶液中通入A至显中性,根据电荷守恒可得:c(NH4+)+ c(H+)= c(Cl-)+c(OH-)。由于溶液显中性,所以c(H+)= c(OH-)。因此c(NH4+)=c(Cl-),盐电离程度远大于水的电离,因此溶液中各离子浓度由大到小的顺序为c(NH4+)=c(Cl-)>c(OH-)=c(H+);(3)常温下取M的饱和溶液与AgI的饱和溶液等体积混合,由于AgCl的溶解度大于AgI,所以溶液中c(Cl-)>c(I-),n(Cl-)>n(I-),所以再加入足量的AgNO3浓溶液发生反应,则生成沉淀的物质的量较多的是AgCl。(4)由于b电极进入KOH和尿素的混合溶液,从a电极区排除的反应溶液中无尿素,由于在尿素中N元素的化合价是-3价,所以发生氧化反应,b电极反应式是:CO(NH2)2+8OH--6e- =CO32-+N2↑+6H2O。在a电极区发生还原反应:2H++2e-=H2↑。n(H2)=0.112L÷22.4L/mol=0.005mol,转移电子的物质的量是0.005mol×2=0.01mol。在整个闭合回路中电子转移数目相等,m(CO(NH2)2)=[ 0.01mol÷6] ×60g/mol=0.1g。
考点:考查元素及化合物的推断、离子浓度大小比较、电解原理在气体制取中的应用的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
理论上不能用于设计成原电池的反应是
A.2H2(g)+O2(g)==2H2O(l) △H<0
B.HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C.2Al(s)+3Cl2(g)==2AlCl3(s) △H<0
D.Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
阿维A酯是一种皮肤病用药,可由原料X经过多步反应合成:
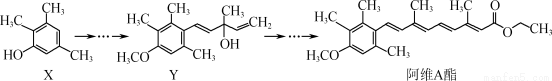
下列叙述正确的是
A.有机物X与Y互为同系物
B.有机物Y与阿维A酯均能与NaOH溶液反应
C.一定条件下1 mol阿维A酯能与4 mol H2发生加成反应
D.X中有6种化学环境不同的氢原子,Y中有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
B.Na2FeO4既是氧化产物又是还原产物
C.Na2O2在上述反应中只作氧化剂
D.2 mol FeSO4发生反应时,共有10 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.二氧化碳结构式:O-C -O
B.S2-的结构示意图: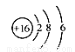
C.中子数为146、质子数为92的铀(U)原子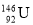
D.NH5的电子式为: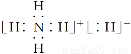
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
下列说法合理的是
A.金属锂、镁在氧气中燃烧的产物分别为Li2O、MgO
B.H—F、H—O、H—N三个共价键的极性逐渐增强
C.若X+和Y2-的核外电子层结构相同,则元素电负性X>Y
D.邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.用醋酸溶液除水垢:CaCO3+2H+==Ca2++H2O+CO2↑
B.向FeBr2溶液中通入足量C12:Fe2++2Br一+C12==Fe3++Br2+2C1一
C.向Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]一+CO2==Al(OH)3↓+HCO3一
D.向Ba(OH)2溶液滴加NaHSO4溶液至中性:H++SO42-+Ba2++OH一==BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合试卷(解析版) 题型:实验题
(16分)草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O。现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:
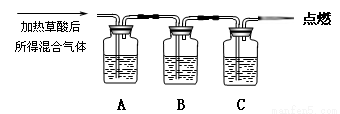
A、乙醇 B、 C、NaOH溶液。
(1)B中盛装的试剂 (填化学式)
(2)A中加入乙醇的目的是 。
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4·2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是 (用离子方程式表示)。
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理: MnO4- + H2C2O4 + = Mn2+ + CO2↑+ H2O
(1)配平上述离子方程式。
(2)滴定时KMnO4溶液应盛装于 (填 “酸式”或“碱式”)滴定管中。
Ⅱ、探究影响化学反应速率的因素
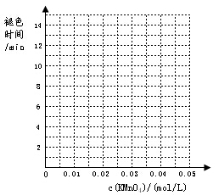
实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6'55'' | (a) |
0.2 | 2 | 0.005 | 4 | 0.12 | 5'17'' | ||
0.2 | 2 | 0.01 | 4 | 0.12 | 3'20'' | ||
0.2 | 2 | 0.02 | 4 | 0.12 | 9'05'' | ||
0.2 | 2 | 0.03 | 4 | 0.12 | 11'33'' | ||
0.2 | 2 | 0.04 | 4 | 0.12 | 14'20'' |
下表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是 ;
(2)根据表中数据在坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图像;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com