
| A. | 人体不能缺碘,需要正常补碘.“加碘食盐”中的“碘”是指碘元素 | |
| B. | 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝 | |
| C. | “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物 | |
| D. | 水壶中产生的水垢可用食醋清洗除去 |
分析 A.加碘食盐中加入的是碘酸钾;
B.焰色反应时,蘸取样品之前需用稀盐酸溶液清洗铂丝;
C.绿色化学核心就是要利用化学原理从源头消除污染;
D.水垢的主要成分是碳酸钙等.
解答 解:A.加碘食盐中加入的是碘酸钾,不是碘单质,故A正确;
B.焰色反应时,蘸取样品之前需用稀盐酸溶液清洗铂丝,因为盐酸受热易挥发,但是硫酸不具有该性质,故B错误;
C.绿色化学核心就是要利用化学原理从源头消除污染,在于不再使用有毒、有害的物质,不再产生废物,故C正确;
D.水垢的主要成分是碳酸钙等,这些成分能与食醋中的醋酸反应生成可溶性的醋酸盐,故D正确.
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | K+ | B. | I- | C. | SO42- | D. | CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
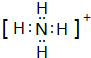 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则40gNaOH固体与稀盐酸完全中和,放出的热量即为57.3 kJ | |
| B. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,则△H1<△H2 | |
| C. | 已知H2(s)+Cl2(g)=2HCl (g)△H=-184.6 kJ/mol,则反应物总能量小于生成物总能量 | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中一定存在CO32-、SO42-、Na+ | B. | 溶液中 c (Na+)≥0.6mol•L-1 | ||
| C. | 溶液中一定没有Ba2+,可能存在Cl- | D. | 溶液中n(SO42-)≤0.02 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw变小 | |
| C. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
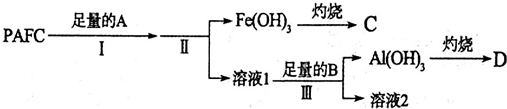
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com