
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,根据体积比较计算甲烷、氢气的物质的量,再根据热化学方程式计算燃烧放出的热量,注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:标准状况下,112L甲烷和氢气混合气体的物质的量为$\frac{112L}{22.4L/mol}$=5mol,甲烷和氢气的体积之比为4:1,所以甲烷的物质的量为:5mol×$\frac{4}{5}$=4mol,氢气的物质的量为5mol-4mol=1mol,
由①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-Q1;
②2H2(g)+O2(g)=2H2O(g)△H=-Q2
③H2O(g)=H2O(l)△H=-Q3
根据盖斯定律①+③×2可得,CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-(Q1+2Q3),
根据盖斯定律②+③×2可得,2H2(g)+O2(g)=2H2O(l)△H=-(Q2+2Q3),
4mol甲烷燃烧放出的热量为4×(Q1+2Q3)kJ,1mol氢气燃烧放出的热量为1×0.5×(Q2+2Q3),
所以放出的热量为4×(Q1+2Q3)+1×0.5×(Q2+2Q3)=4Q1+0.5Q2+9Q3kJ,
故选:D.
点评 本题考查根据热化学方程式计算反应热,难度不大,注意根据水的状态选择相应的热化学方程式计算反应热.


科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| B. | 可用浓硝酸鉴别含苯环的蛋白质 | |
| C. | 工业上利用油脂在碱的催化作用下水解生产肥皂 | |
| D. | 淀粉水解与纤维素水解得到的最终产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 反应CaSO4(s)+CO32-(aq)?CaCO3 (s)+SO42-(aq) 的实质就是沉淀溶解平衡的移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的浓度不再变化 | |
| B. | 混合气体的压强不再变化 | |
| C. | 混合气体的密度不再变化 | |
| D. | 混合气体的平均相对分子质量不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
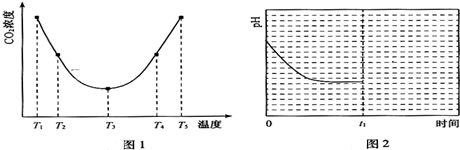
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
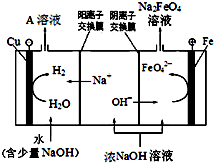 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
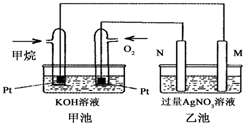 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com