
 将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:
将4mol SO2与2mol O2的混合气分别置于容积相等的甲、乙两容器中,发生反应:2SO2(g)+O2(g)?2SO3(g);△H<0,在相同温度下使其均达到平衡状态.甲是恒压容器,乙是恒容容器.甲容器达到平衡状态时,测得混合气体的物质的量为4.2mol;乙容器经50s达到平衡状态.请回答:分析 (1)根据差量法计算二氧化硫的物质的量,从而计算其转化率;恒容条件下该反应的正反应是气体体积减小的反应,随着反应的进行,气体物质的量减小,气体压强减小,甲是恒压条件下反应,所以反应过程中甲中压强大于乙,增大压强平衡正向移动;压强越大反应速率越大,反应到达平衡的时间越短;
(2)到达平衡后,甲中二氧化硫物质的量小于乙,要使两个容器中二氧化硫物质的量相等,可以使甲的平衡逆向移动或乙的平衡正向移动.
解答 解:(1)设参加反应的二氧化硫物质的量为x,
2SO2(g)+O2(g)?2SO3(g)物质的量减少
2mol 1mol
x (4+2-4.2)mol
2mol:1mol=x:(4+2-4.2)mol
x=$\frac{(4+2-4.2)mol×2mol}{1mol}$=3.6mol
二氧化硫转化率=$\frac{3.6mol}{4mol}×100%$=90%,
恒容条件下该反应的正反应是气体体积减小的反应,随着反应的进行,气体物质的量减小,气体压强减小,甲是恒压条件下反应,所以反应过程中甲中压强大于乙,增大压强平衡正向移动;压强越大反应速率越大,反应到达平衡的时间越短,甲中压强大于乙导致甲反应速率大于乙,所以乙所用时间长,
故答案为:90%;小于;
(2)到达平衡后,甲中二氧化硫物质的量小于乙,要使两个容器中二氧化硫物质的量相等,可以使甲的平衡逆向移动或乙的平衡正向移动,
A.保持温度不变,适当扩大甲容器的容积,减小压强,平衡逆向移动,故正确;
B.保持容积不变,使乙容器升温,平衡逆向移动,导致两个容器中二氧化硫物质的量不等,故错误;
C.保持容积和温度不变,向乙容器中加入适量SO3(g),平衡逆向移动,二氧化硫物质的量增大,所以两个容器中二氧化硫物质的量不可能相等,故错误;
D.保持容积和温度不变,向甲容器中加入适量SO3(g),平衡逆向移动,二氧化硫物质的量增大,所以两个容器中二氧化硫物质的量可能相等,故正确;
故选AD.
点评 本题考查化学平衡有关计算及化学平衡影响因素,为高频考点,明确恒压与恒容对二氧化硫转化率的影响是解本题关键,难点是等效平衡的建立,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.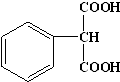 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的原子结构示意图: | |
| B. | NH4Cl的电子式: | |
| C. | 铝离子中的质子数和电子数之比为13:10 | |
| D. | 原子核内有30个中子的铁原子:2656Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 二氧化硫和乙烯都能使溴水溶液褪色 | |
| C. | 二氧化硫和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 大量Na2SO4和甲醛都能使蛋白质从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A与气体B的相对分子质量之比为m:n | |
| B. | 同质量的气体A与气体B,所含分子数目之比为n:m | |
| C. | 相同条件下,等体积的气体A与气体B的质量之比为m:n | |
| D. | 相同条件下,气体A与气体B的密度之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 100mL 1mol•L-1NaCl 溶液 | B. | 50mL 1mol•L-1AlCl3 溶液 | ||
| C. | 75mL 1mol•L-1BaCl2 溶液 | D. | 75mL 2mol•L-1NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com