
 环境监测测定水中溶解氧的方法是:
环境监测测定水中溶解氧的方法是:| 滴定次数 | 待测液的体积/mL | 0.1000mol•L-1 Na2S2O3的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (1)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化;碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去;
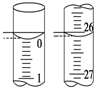
(2)滴定管的0刻度在上方,故图1、2正确.0~1刻度间每一小格为0.10mL,如图1显示0.00ml,图2显示26.10ml;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差;
(4)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值;根据关系式:O2~2MnO(OH)2~2I2~4S2O32-可计算水样中溶解氧的浓度.
解答 解:(1)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化,碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去,半分钟不恢复蓝色证明达到滴定终点;
故答案为:锥形瓶中溶液颜色变化;蓝;无;在半分钟内不变色;
(2)滴定管的0刻度在上方,故图1、2正确.0~1刻度间每一小格为0.10mL,如图1显示0.00ml,图2显示26.10ml,可知则所用Na2S2O3溶液的体积为26.10ml-0.00ml=26.10mL,
故答案为:26.10;
(3)A.读数:滴定前读酸液体积时平视,滴定后读酸液体积时俯视,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏小,故A正确;
B.未用标准液润洗滴定管,标准液的浓度偏小,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故B错误;
C.用固体配制Na2S2O3溶液时,其固体中含有对反应体系无影响的杂质,造成标准液的浓度偏小,消耗的标准液的体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏大,故C错误;
D.待测液的滴定管之前有气泡,取液后无气泡,导致V(待测)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析c(待测)偏小,故D正确;
故答案为:A、D;
(4)第2组数据误差较大,舍去,根据第1组和第3组数据计算Na2S2O3的体积平均值为:$\frac{26.11+26.09}{2}$mL=26.10mL;
根据反应:2Mn2++O2+4OH-═2MnO(OH)2,MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O,I2+2S2O32-═S4O62-+2I-,可知关系式:
O2~2MnO(OH)2~2I2~4S2O32-
32g 4mol
m 0.1000mol/L×26.10mL×10-3L/mL
m=$\frac{32g×0.1000mol/L×26.10mL×1{0}^{-3}L/mL}{4mol}$=20.88×10-3g,则1L水样含氧气质量为:$\frac{20.88×1{0}^{-3}g}{0.025L}$=0.8352g/L;
答:水中溶解氧的量为0.8352g/L.
点评 本题考查了氧化还原滴定的操作、仪器、误差分析和数据处理,题目难度中等,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
B.向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO2-4
C.在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加
D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强。下列说法正确的是
A. X的气态氢化物的热稳定性比O(氧)的强
B. 元素Z、W的简单离子具有相同的电子层结构
C. Y、Z、W的最高价氧化物对应的水化物之间能相互反应
D. 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
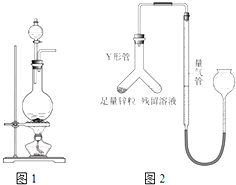 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
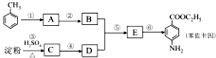 甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
甲苯是一种重要的化工原料,可以参与合成很多物质.如图为以甲苯为原料得到药物苯佐卡因的合成路线.
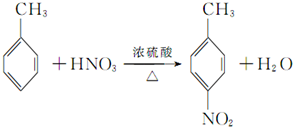 ,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.
,该反应要控制好低温条件,否则会生成一种新物质F,该物质是一种烈性炸药,F的名称为2,4,6-三硝基甲苯.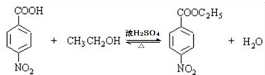 .
. .
.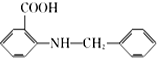 是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图:
是一种药物中间体,请写出以甲苯为主要原料制备该中间体的合成路线流程图: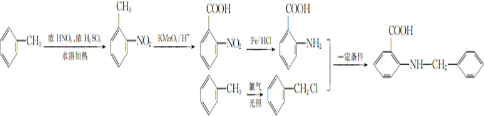 .
.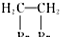
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
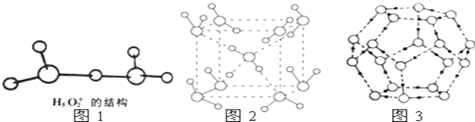
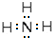 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com