
【题目】物质在下列应用中,利用了其还原性的是
A. 纯碱去油污 B. 明矾净水 C. 铝冶炼金属 D. 漂粉精漂白织物
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4gSO2和8.0gSO3相比较,下列结论中错误的是
A.它们所含氧原子数目之比为2:3
B.它们的体积之比为1:1
C.它们所含原子数目之比为3:4
D.它们的分子数目之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在同温同压下,ag甲气体和2ag乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A. 同温同压下甲和乙的密度之比为1∶1
B. 甲与乙的相对分子质量之比为1∶1
C. 同温同体积下等质量的甲和乙的压强之比为1∶1
D. 等质量的甲和乙中所含原子个数之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4—(绿色)、Cr2O72—(橙红色)、CrO42—(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答:
(1)Cr3+与Al3+的化学性质相似,往Cr2(SO4)3溶液中滴入NaOH溶液直至过量,可观察到的现象是 。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0molL﹣1的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示。
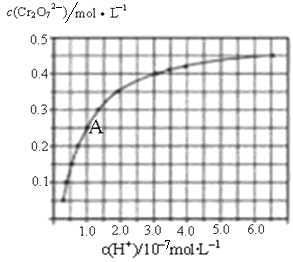
 ①用离子方程式表示Na2CrO4溶液中的转化反应 。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增强,CrO42﹣的平衡转化率 (填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
(3)用K2CrO4为指示剂,以AgNO3标准液滴定溶液中的Cl﹣,Ag+与CrO42﹣生成砖红色沉淀时到达滴定终点。当溶液中Cl﹣恰好完全沉淀(浓度等于1.0×10﹣5molL﹣1)时,溶液中c (Ag+)为 molL﹣1,此时溶液中c(CrO42﹣)等于 molL﹣1。(Ksp(Ag2CrO4)=2.0×10﹣12、Ksp(AgCl)=2.0×10﹣10)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72﹣还原成Cr3+,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ/mol,
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A.2N2H4(g)+N2O4(g)=3N2(g) +4H2O(g) ΔH=-542.7 kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1059.3 kJ/mol
C.N2H4(g)+![]() N2O4(g)=
N2O4(g)=![]() N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
N2(g)+2H2O(g) ΔH=-1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子的浓度为
A.0.1(b-2a)mol·L-1
B.10(2a-b)mol·L-1
C.10(b-2a)mol·L-1
D.10(b-a)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下10 mL pH=3的醋酸溶液作如下改变时,说法正确的是
A.加水稀释到原体积的10倍, 溶液的pH=4
B.加水稀释,溶液中![]() 不变,n(OH-)增大
不变,n(OH-)增大
C.加入10 mL pH=11的NaOH溶液,所得混合液的pH=7
D.加入少量醋酸钠固体, 则平衡CH3COOH![]() CH3COO-+ H+逆向移动,K变小
CH3COO-+ H+逆向移动,K变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列电化学装置说法正确的是( )
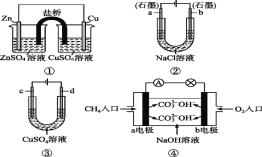
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④电池负极的电极反应式为O2+4e-+2H2O=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com