
| A、对钢材“发蓝”(钝化) |
| B、选用铬铁合金 |
| C、外接电源负极 |
| D、连接锌块 |
科目:高中化学 来源: 题型:
| A、Q3>Q2>Q1 |
| B、Q1>Q2>Q3 |
| C、Q1>Q3>Q2 |
| D、Q2>Q1>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
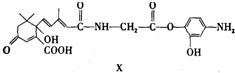
| A、X能发生氧化、取代、酯化、加聚、缩聚反应 |
| B、X与FeCl3溶液不能发生显色反应 |
| C、1mol X与足量NaOH溶液反应,最多消耗2mol NaOH |
| D、X的分子式为C23H26N2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沸点大小关系为:乙酸>水>乙醇>溴乙烷>甲醛 |
| B、在水中溶解度大小关系为:乙酸异戊酯<苯酚<乙醇 |
| C、用水可以区别苯、乙醛、四氯化碳、醋酸、硝基苯五种液体 |
| D、甲醛、乙酸任意比混合,等质量的混合物完全燃烧耗氧量和生成CO2量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物光合作用需要CO2,但是大气中CO2过多引起温室效应会导致气候恶化 |
| B、汽车尾气中的NO会污染城市空气,雷电产生的NO会转化为NO3- 并随雨水滋养地表植物 |
| C、臭氧层中的O3可以吸收宇宙射线福佑生灵,地表上的O3却可能伤害人的呼吸道 |
| D、少量Cl2可用于水体净化消毒,大量Cl2会导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
| D、为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物中可能含有离子键 | ||||||
| B、Ca2+、K+、Cl-、S2-四种粒子的离子半径依次减小 | ||||||
C、
| ||||||
| D、第ⅥA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CrO5中Cr元素的化合价为+10 |
| B、过氧化铬中含有极性共价键、非极性共价键和离子键 |
| C、过氧化铬是酸性氧化物,具有较强的氧化性 |
| D、上述反应每转移0.2mol电子就能生成2.24L O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com